Статьи
Иммунитет и модуляция предшественников миелопоэза
За последние 50 лет удалось многое узнать о физиологии нейтрофилов — их больше не рассматривают как короткоживущие, неизбирательные фагоциты иммунной системы, а относят к ее незаменимым компонентам. Физиологически плод сильно отличается от взрослого человека, поэтому фенотипические и функциональные характеристики гранулоцитов новорожденных могут иметь жизненно важное значение.
Нейтрофилы — жизненно важный компонент врожденного иммунитета, поскольку они одними из первых реагируют на инвазию патогенных микроорганизмов и обеспечивают защиту от бактериальных, вирусных и грибковых инфекций. Неонатальные нейтрофилы адаптированы к внутриутробным условиям, что позволяет избегать нежелательных провоспалительных реакций. Подавление функции нейтрофилов необходимо для создания здорового микробиома в послеродовом периоде, однако одновременно это может помешать развитию достаточного ответа при воздействии патогенных организмов.
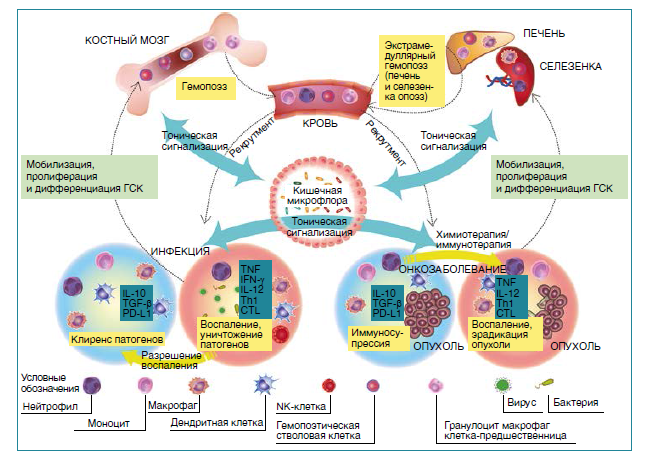
Беременность уникальна с точки зрения адаптации иммунной системы матери и плода, так как, несмотря на обмен аллоантигенами, в норме между ними не происходит иммунологического конфликта. Сегодня известно, что состояние иммунологической толерантности обеспечивается не только иммуносупрессивными механизмами, активирующимися в организме материи, но и особенностями эмбрионального и фетального развития иммунной системы плода. Иммунная система матери должна обеспечивать первичную защиту развивающегося плода от внутриутробных инфекций, а также осуществлять иммунологическую протекцию новорожденного в течение первых месяцев жизни. Эта защита достигается не только за счет плацентарного транспорта материнских иммуноглобулинов в последний триместр беременности, но и через грудное молоко, богатое антимикробными белками, олигосахаридами и иммуноглобулинами. Однако такой защиты может оказаться недостаточно, поэтому иммунная система плода и новорожденного должна уметь самостоятельно реагировать на внутриутробную инфекцию. В норме плод развивается в условно стерильной среде, поэтому адаптивные иммунные реакции новорожденных наивны из-за отсутствия должного уровня антигенной стимуляции и иммуносупрессивных механизмов, сдерживающих ответ на материнские аллоантигены. Следовательно в раннем неонатальном периоде младенцев должны полагаться на систему врожденного иммунитета, где жизненно важная роль отводится нейтрофилам, первым циркулирующим иммунным клеткам, реагирующим на различные инфекции. Однако нейтрофилы новорожденного и взрослого фенотипически и функционально отличаются. Выраженность этих изменений обратно пропорциональна гестационному возрасту, что говорит о динамическом развитии этих клеток в течение всей беременности — от самых ранних клеток-предшественников гемопоэза в желточном мешке до миелоидных клеток-предшественников в костном мозге на седьмом месяце беременности. По - этому нельзя исключать, что крайне высокий риск развития неонатальных инфекций и сепсиса у недоношенных в том числе связан с функциональной недостаточностью нейтрофилов. Кроме того, на фенотип и функцию нейтрофилов напрямую влияют факторы иммунологического окружения, которые значительно различаются у плода и новорожденного. Роды — ключевое событие для иммунной системы плода, так как новорожденный за короткий период подвергается воздействию огромного числа антигенов различных микроорганизмов, большая часть которых позже станет важным компонентом его здорового микробиома. Сразу после разрыва плодных оболочек новорожденный впервые сталкивается с колоссальным количеством микроорганизмов в составе нормальной микробиоты матери — тогда толерантность нейтрофилов новорожденного к антигенам необходима, чтобы не допустить развитие неадекватных провоспалительных реакций. После установления симбиотических отношений между микробиотой и макроорганизмом функция нейтрофилов должна вернуться к обеспечению иммунологической защиты. Вмешательства, препятствующие естественному обсеменению новорожденного (кесарево сечение или антибиотики во время родов или в послеродовой период), могут нарушить этот баланс и подвергнуть ребенка повышенному риску позднего неонатального сепсиса, некротического энтероколита и других инфекционных осложнений. Кроме того, естественные роды сопровождаются высвобождением гормонов, кортизола и катехоламинов, также влияющих на фенотип и функцию клеток иммунной системы, в том числе нейтрофилов, моноцитов и NK-клеток. Чрезмерное использование антибиотиков в неонатальном периоде чревато нарушениями микробиома с долгосрочными последствиями: известно, что макролидные антибиотики ингибируют нормальную активацию и рекрутинг нейтрофилов, а такие изменения во взаимодействии микробиоты и иммунной системы могут значительно влиять на неонатальную заболеваемость и смертность. У недоношенных с ОНМТ изменения в составе микробиома предшествуют возникновению некротического энтероколита. Нарушения кишечного микробиома могут способствовать развитию неонатального сепсиса.
На нейтрофилы влияют компоненты и метаболиты как резидентной, так и патогенной микробиоты. Микрофлора кишечника может влиять на продукцию нейтрофилов посредством модуляции миелопоэза в костном мозге. Кроме того, истощение нормальной микробиоты у новорожденных повышает их восприимчивость к инфекциям, предположительно, из-за развития нейтропении. Микрофлора индуцирует выработку специфических медиаторов, таких как IL-17, IL-7, IL-6, и тромбопоэтина, которые влияют на высвобождение ГКСФ. Эксперименты на животной модели показали, что микробиота новорожденных мышей индуцирует выработку IL-17 лимфоидными клетками в кишечнике, что увеличивает выработку ГКСФ и, следовательно, продукцию нейтрофилов. У взрослых мышей это взаимодействие также увеличивает количество зрелых форм нейтрофилов в циркуляторном пуле, характеризующихся повышенным уровнем экспрессии интегрина αMB2 и более выраженной продукцией NET при воспалении. Кроме того, изменения микробиома на фоне диеты с высоким содержанием жиров также влияют на гемопоэз в целом. Помимо воздействия на продукцию нейтрофилов, микробиота регулирует и их функцию. Короткоцепочечные жирные кислоты в качестве метаболитов, происходящих из микробиома кишечника, подавляют миграцию и активацию нейтрофилов, а также способствуют разрешению воспаления за счет индукции апоптоза нейтрофилов и эффероцитоза апоптотических клеток макрофагами. Микробиота кишечника регулирует метаболизм желчных кислот, которые влияют на функцию клеток иммунной системы. Так, TUDCA напрямую подавляет активацию нейтрофилов и их привлечение к воспаленной ткани.
Перекрестное взаимодействие между микробиотой и иммунными клетками также может осуществляться через экзосомы. Состав бактериальных мембранных везикул (MV), как и эукариотических внеклеточных везикул (EV), зависит от клеточного компонента, из которого они происходят. Внеклеточные везикулы могут содержать множество компонентов, включая белки, сигнальные молекулы, рецепторы, метаболиты и малые РНК. MV используются бактериями для межклеточной коммуникации и горизонтальной передачи генов (например, генов устойчивости к антибиотикам). Бактериальные MV микробиоты могут влиять и на клетки хозяина. Показано, что малые РНК в составе MV P. aeruginosa могут способствовать снижению иммунного ответа, сокращая ЛПС-индуцированную секрецию IL-8 культивированными первичными эпителиальными клетками дыхательных путей человека, а также активацию нейтрофилов в легких мыши. MV из S. aureus оказывают провоспалительное действие на эндотелиальные клетки, повышая экспрессию E-селектина, VCAM-1, ICAM-1 и IL-6.
Так как микробиота способна напрямую влиять на функцию нейтрофилов, преили пробиотики могут выступать иммуномодуляторами (особенно у недоношенных детей с большим риском нарушения микрофлоры кишечника) — неоднократно обсуждалось, что их можно использовать в неонатальной практике для улучшения состава микробиоты и иммунологической регуляции. В рамках двойного слепого РКИ, где изучали влияние B. longum BB536 (BB536) на состав кишечной микробиоты и иммунный ответ у доношенных детей (n = 256), выявили рост числа IFN-γ — секретирующих клеток и соотношения IFN-γ и IL-4, а также более высокие показатели отношения бифидобактерий и энтеробактерий, что, по-видимому, связано с усилением Th1-ответа. На взрослой популяции было показано, что пробиотики улучшают функцию нейтрофилов и цитокиновый ответ у пациентов с алкогольным циррозом печени. В животной модели продемонстрировано, что Lactobacillus rhamnosus подавляют образование NET (экстраклеточные нейтрофильные ловушки) у мышей. Однако конкретных сообщений о влиянии пробиотиков на нейтрофилы у новорожденных нет. Согласно анализу EV из пробиотических штаммов, первые обладают противовоспалительным действием и способствуют иммунологической регуляции. Таким образом, преимущество клинического применения EV перед непосредственным использованием пробиотических микроорганизмов заключается в их лучшей биобезопасности, а также стандартизации при производстве и менее требовательных условиях хранения, хотя пока клинических испытаний в этом направлении нет.
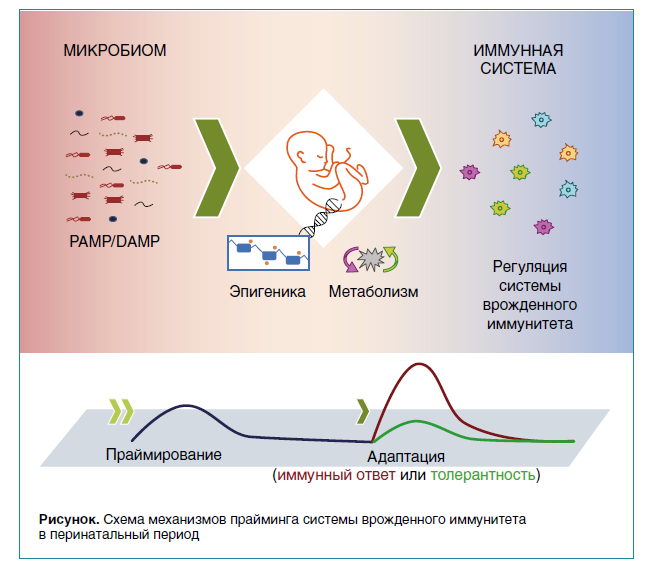
Недавно появилась новая концепция «микробиологической памяти», цель которой — объяснить роль микробиома в эпигенетической регуляции клеток иммунной системы. Несмотря на короткую жизнь зрелых нейтрофилов, эпигенетическая регуляция может быть реализована через ГСК и миелоидные клетки-предшественники в костном мозге. Кроме того, на животной модели было показано, что введение β-глюкана мышам индуцировало в миелоидных ГСК повышенную транскрипцию генов, связанных с клеточным циклом и дифференцировкой, что было связано с усилением передачи сигналов медиаторами врожденного иммунитета, такими как IL-1β, ГМ-КСФ, а также с адаптацией метаболизма глюкозы и биосинтеза холестерина. Такая стимуляция миелопоэза усиливала ответ на вторичную стимуляцию ЛПС и снижала эффект индуцированной химиотерапией миелосупрессии. Выяснилось, что эти эффекты тесно связаны с метаболическими изменениями, обычно обусловленными эпигенетическими перестройками. Известно, что сепсис сопровождается метаболическими нарушениями в сторону аэробного гликолиза. В то же время продукты промежуточного метаболизма могут способствовать как индукции иммунного ответа, так и развитию иммунологической толерантности, оказывая влияние на ключевые функции нейтрофилов. Таким образом, праймирование миелоидных предшественников в костном мозге — неотъемлемый компонент развития врожденного иммунитета, который до настоящего времени считался связанным исключительно с функциональными изменениями зрелых миелоидных клеток на периферии. Тогда микробиоту можно рассматривать в качестве ключевого праймера, так как она непрерывно воздействует на все звенья врожденного иммунитета (рис.). Воздействие патоген-ассоциированных молекулярных паттернов (PAMP) на систему врожденного иммунитета способствует эпигенетическим изменениям и метаболическому перепрограммированию, что приводит к развитию длительной адаптации, проявляющемуся в повышении или понижении реактивности иммунных клеток.
Таким образом, микробиом — пластичная система, поэтому в перспективе можно подобраться к рычагам управления эпигенетическими модификациями, минимизировать действие неблагоприятных факторов и обеспечить оптимальные условия для клеток иммунной системы. Уже сегодня становится ясно, что открытия в области эпигенетики в скором времени поднимут биологическую науку на качественно новый уровень.
Читайте также
- Большие возможности малоинвазивной хирургии
- РМП: иммунотерапия для всех?
- EAU: новое в диагностике рака мочевого пузыря
- Рак мочевого пузыря и рак почки при беременности
- Осложнения после биопсии, которые можно предотвратить
- Ретроградное и чрескожное удаление камней — единство и борьба противоположностей
- COVID-19 и тестостерон
- Ф.И. Синицын — основатель отечественной андрологии

















