Статьи
Хирургия рака легкого – может ли «меньше» стать «лучше»?
ИСТОРИЯ ХОДИТ ПО КРУГУ?
«Золотым стандартом» в лечении ранних стадий НМРЛ считается лобэктомия, выполняемая открыто или торакоскопически, однако в последние годы неуклонно возрождается интерес к выполнению более экономных операций — сегментэктомий.
«Возможность выполнения сегментэктомии при раке легкого впервые описал R. J. Jensik еще в 1973 году, — поясняет д. м. н. А. Б. Рябов. — В течение последующих десятилетий тема сублобарных анатомических резекций легких в онкологии была предана забвению в связи с эпохой «сверхрадикализма» в онкохирургии. Интерес к сегментэктомиям при раке легкого возродился на рубеже XX–XXI веков. Предрасполагающим фактором этого процесса явилось постепенное увеличение доли выявляемого на ранней стадии рака легкого в результате роста разрешающей способности рентгенологической диагностики и внедрения КТ- скрининга рака легкого в ряде экономически развитых стран».
Рекомендации по приоритетности лобэктомии построены на единственном опубликованном проспективном рандомизированном исследовании, напрямую сравнившем результаты сублобарных резекций с результатами лобэктомий при НМРЛ размерами менее 3 см (T1N0). Исследование было проведено группой по изучению рака легкого (Lung Cancer Study Group) и опубликовано в 1995 году (Ann Thorac Surg, 1995). Результаты исследования были неутешительными: увеличение частоты рецидивов в 3 раза (17,2 % vs 6,4 %) и увеличение смертности на 30 %. Следует, однако, упомянуть о недостатках данного исследования: 1) почти треть выполненных сублобарных резекций (32,8 %) по сути представляли из себя атипичную резекцию опухоли, а не анатомическую сегментэктомию, что могло стать причиной столь высокой частоты рецидивов 2) основной критерий включения пациентов в исследование — опухоли Т1, однако в годы проведения исследования эта категория включала в себя опухоли диаметром до 3 см, что также могло внести существенный вклад в получение неудовлетворительных результатов.
В противоположность представленным данным, крупное исследование по типу «case-control» показало сопоставимые показатели выживаемости и частоты рецидивов при выполнении сегментэктомии или лобэктомии больным с I стадией НМРЛ (J Clin Oncol, 2014). В исследовании в соотношении 1:1 были сопоставлены по 312 больных НМРЛ I стадии, и при медиане наблюдения в 5,4 лет не было выявлено различий в 5-летней общей выживаемости (54 % vs 60 %, Р = 0,258), безрецидивной выживаемости (70 % vs 71 %, Р = 0,467), частоте локальных и отдаленных рецидивов (5,5 % vs 5,1 %, Р = 1,00 и 14,8 % vs 11,6 %, Р = 0,29 соответственно). Интересной находкой исследования является отсутствие различий в безрецидивной выживаемости среди больных с опухолями T1a (<2 cм; Р = 0,585), T1b (2–3 см; Р = 0,395) и даже T2a (3–5 см; Р = 0,432). Другой анализ базы данных SEER (J Thorac Dis, 2017) ретроспективно сравнил результаты выполнения лобэктомии и сегментэктомии больным НМРЛ при опухолях ≤3 см. В анализ было включено 1156 и 17748 больных, которым была выполнена сегментэктомия или лобэктомия соответственно. При условии выполнения медиастинальной лимфодиссекции также не выявлено различий в общей (HR: 1,081 (0,937–1,248), P = 0,286) и канцер-специфической выживаемости (HR: 1,039 (0,861–1,253), P = 0,692).
Эти данные позволили возродить интерес и вновь, как и несколько десятилетий назад, вернуться к вопросу: а может быть, сегментэктомию по праву можно назвать операцией, которая «радикальна, насколько необходимо, но экономна, насколько возможно»?
БЫТЬ ИЛИ НЕ БЫТЬ?
С 1970-х годов сублобарные резекции в основном рассматривались и продолжают рассматриваться как «вынужденные» операции, т. е. в большинстве случаев им отдают предпочтение при выборе объема вмешательства у пожилых пациентов или у больных с тяжелой легочной патологией, не позволяющей выполнить лобэктомию. Но на вопрос, приемлемо ли намеренно выполнять сегментэктомию у сохранных больных, пока, к сожалению, сложно дать однозначный ответ.
Некоторые исследования постарались ответить на этот сложный вопрос и снять с сублобарных резекций ярлык «операций запаса». В мета-анализе исследований, в которых пациентам с ранней стадией НМРЛ и без выраженной легочной патологии целенаправленно выполнялась сублобарная резекция, а не лобэктомия, не было выявлено различий в выживаемости при сравнении сегментэктомии и лобэктомии в группе больных с периферически расположенным НМРЛ <2 см в диаметре, а также при опухолях диаметром >1см с благоприятными гистологическими характеристиками, такими как опухоли с затемнением по типу матового стекла (опухоли GGO (ground-glass opacity)) и микроинвазивные аденокарциномы (Lung Cancer, 2015).
Подавляющее большинство экспертов считают оправданной сегментэктомию при размере опухоли менее 2 см. Мета-анализ Bao F. et al. (Eur J Cardiothorac Surg, 2014) также позволил четко доказать это: выполнение сегментэктомии по поводу опухоли <2 см в диаметре не ухудшало результаты лечения по сравнению с лобэктомией.
Однако необходимо отметить, что качество вошедших в мета- анализы исследований оставляет желать лучшего: только одно исследование было рандомизированным. С другой стороны, малое количество проспективных рандомизированных исследований может быть объяснено необходимостью включения огромного числа (порядка тысячи) пациентов для проведения статистически достоверного исследования по типу «non-inferiority». В настоящее время уже проводятся два крупных проспективных рандомизированных исследования в США (CALBG 140503) и Японии (JCOG0802/WJOG4607L), которые, как надеются торакальные хирурги, внесут ясность в вопрос о роли сегментэктомии у больных с ранними стадиями НМРЛ.
«Следует признать, что на основании данных литературы, существующих на настоящий момент, онколог не может предложить больному с диагнозом НМРЛ I стадии сублобарную резекцию как более эффективную операцию, по сравнению с лобэктомией, — отмечает к. м. н. А. М. Амиралиев. — Но это, по моему мнению, лишь вопрос времени; и если в ближайшем будущем упомянутые выше крупные проспективные американские и японские исследования докажут онкологическую целесообразность сегментэктомий, это даст зеленый свет целому ряду рандомизированных проспективных исследований, которые позволят более ясно определить преимущество сублобарных резекций в сохранении функциональных показателей. Ведь во всех ретроспективных исследованиях пациенты в группе сегментэктомии a priori отличались скомпрометированным коморбидным статусом и низкими показателями респираторной функции. По моему мнению, сегментэктомия показана “сохранному” пациенту с периферическим НМРЛ IA стадии с размером очага не более 20 мм при соблюдении ключевого условия разделения легочной паренхимы: возможности обеспечения отступа края резекции на расстояние не менее диаметра самого опухолевого очага».
НЕ СБИТЬСЯ С ПУТИ
Сегментэктомию по праву относят к разряду наиболее сложных анатомических резекций легких в связи с анатомической вариабельностью ангиоархитектоники и техническими трудностями при вмешательстве по поводу определенных локализаций опухоли.
«Локализация опухоли тем сложнее в плане подготовки и выполнения сегментэктомии, чем глубже в паренхиме легкого расположено образование, т. е. ближе к корневым структурам, особенно с топикой на границе соседних сегментов, — отмечает д. м. н. О. В. Пикин. — Соответственно, оптимальной локализацией можно считать субплевральное расположение очага, равноудаленное от границ соседних сегментов».
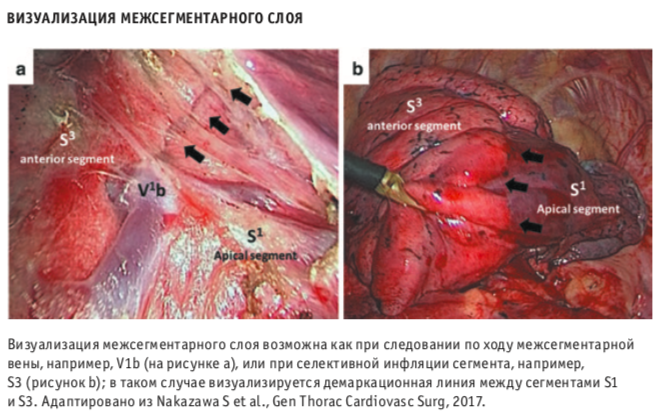
Важным фактором, определяющим сложность выполнения анатомической сегментэктомии, является отсутствие четко выраженных межсегментарных границ паренхимы легкого. Так как же не сбиться с правильного «пути» и соблюсти границу межсегментарных слоев? Одним из методов является инфляционно- дефляционный. «Первоначально хирург на фоне коллапса легкого пересекал сегментарный бронх, после чего легкое повторно раздувалось, что позволяло определить границу резецируемого коллабированного сегмента с соседними сегментами, — поясняет к. м. н. А. М. Амиралиев. — Однако это значительно уменьшало свободное рабочее пространство, особенно при выполнении торакоскопической резекции, в связи с чем стала более популярной инвертированная методика, когда пересечение паренхимы легкого проводят по границе раздутого резецируемого сегмента и коллабированного легкого. Раздуваемый сегмент приобретает более светлую розовую окраску по сравнению с окружающей легочной тканью. При этом определяется четкая граница между сегментами легкого, ориентируясь по которой острым путем или сшивающим аппаратом производится пересечение легочной ткани. Следует, однако, сказать, что применение такой методики может быть затруднено у больных с выраженной эмфиземой или в случае недостаточного коллабирования легкого».
Также популярна методика, при которой после выделения сегментарного бронха вокруг него лигатурой формируют самозатягивающуюся петлю и затягивают ее на фоне вентиляции легкого, что позволяет оставить резецируемый сегмент раздутым на фоне дефляции воздуха из легкого.
Помимо техник, подразумевающих под собой разграничение сегментов с помощью вентиляции, в последнее время набирают популярность методики, основанные на применении флуоресцентного красителя индоцианина зеленого (ICG). Линия демаркации при использовании ICG становится видна в инфракрасном свечении. Конечно же, при интрабронхиальном введении есть вероятность неравномерного распределения красителя по субсегментарным бронхам, а при внутривенном контрастировании доступный для визуализации временной промежуток относительно короткий.
«В торакальном отделении МНИОИ им. П. А. Герцена применяли различные методики определения межсегментарных границ, как инфляционно-дефляционные, так и с использованием красителей, — отмечает д. м. н. О. В. Пикин. — По нашему мнению, предпочтительной является методика введения воздуха или газовой смеси в дистальную культю бронха удаляемого сегмента. Коллективом торакального отделения МНИОИ им. П. А. Герцена запатентовано изобретение способа определения межсегментарной границы с применением катетера Фолея, манжета которого обеспечивает эффективную и прецизионную аэрацию подлежащего удалению сегмента с возможностью оптимального подбора размера катетера в соответствии с диаметром бронха, даже в случае его раннего деления и необходимости инфляции через просвет субсегментарных бронхов».
Интересным представляется вопрос о выборе метода рассечения паренхимы легкого. Данные литературы неоднозначны: в некоторых исследованиях не было выявлено какой-либо зависимости частоты послеоперационных осложнений от метода пересечения паренхимы легкого. В других экспериментальных исследованиях было высказано предположение, что пересечение ткани легкого с помощью степлера компрометирует полное расправление остающихся легочных сегментов (Eur J Cardiothorac Surg, 2011). При этом в литературе нет публикаций, четко продемонстрировавших статистически достоверное преимущество того или иного метода разделения легочной паренхимы. Тем не менее, существуют определенные тенденции и мнения экспертов в торакальной хирургии. Так, родоначальники этих операций (R. Belsey, Е. D. Churchil) и ряд их последователей и приверженцев классического метода сегментэктомии (H. Nomori, N. Tsubotа) пропагандируют острый способ разделения межсегментарных границ при помощи ножниц и электрокоагуляции.
«На мой взгляд, их позиция логично аргументирована: острое разделение позволяет сохранить объем остающихся сегментов, что всецело соответствует основной задаче сублобарной анатомической резекции, — считает к. м. н. А. М. Амиралиев. — Наиболее ярко эта логика проявляется при полисегментарных резекциях, таких как удаление базальных сегментов с сохранением одного лишь сегмента S6, остающегося от нижней доли; применение сшивающего аппарата в таком случае существенно сокращает объем сегмента и представляется парадоксальным».
Основным аргументом в пользу выбора степлерного способа разделения легочной паренхимы является профилактика длительной негерметичности легочной ткани. Сторонники «острого» способа в качестве контраргумента утверждают, что при грамотном предоперационном планировании и скрупулезном интраоперационном соблюдении межсегментарных границ, используя для ориентира направление межсегментарных вен, проблему негерметичности легочной ткани несложно предотвратить.
«По моему мнению, оптимальной является комбинация методов: преимущественное использование биполярной коагуляции и ультразвукового скальпеля; применение степлера оправдано при высоком риске негерметичности у больных с ХОБЛ и эмфиземой», — подводит итог к. м. н. А. М. Амиралиев.
ОПЕРАЦИЯ КАК ЕДИНСТВЕННЫЙ ВАРИАНТ
Возрастание актуальности проблемы лечения больных с ранними формами НМРЛ породило волну энтузиазма в отношении других, нехирургических методов лечения, таких как стереотаксическая лучевая терапия (СЛТ) и методы абляции. Сторонники неинвазивных методов лечения в качестве основных преимуществ указывают отсутствие рисков, связанных с хирургическим вмешательством, а также потенциально эквивалентные показатели отдаленной выживаемости, что в первую очередь представляется актуальным у пожилых пациентов с выраженной патологией сердечно- сосудистой и дыхательной системы. Однако говорить о полном отсутствии рисков, связанных с лечением, было бы неправильно, поскольку лучевые повреждения легких различной степени тяжести также могут в определенной степени негативно повлиять на функциональный статус пациента. С другой стороны, стремление улучшить общую выживаемость у больных с I стадией НМРЛ, когда примерно у трети пациентов могут быть выявлены оккультные микрометастазы в лимфоузлах, обязывает проводить полноценную патоморфологическую оценку степени распространенности заболевания, что возможно только при хирургическом лечении. К тому же, в современную эру получение образца тканей позволяет персонализировано подобрать наиболее оптимальный и эффективный вариант системной терапии, если такой требуется.
«Несомненно, существование альтернативы — это всегда хорошо, – рассуждает д. м. н. А. Б. Рябов. — Складывающиеся в этой ситуации “конкурентные” взаимоотношения радиотерапевтов и торакальных хирургов должны стимулировать развитие обоих направлений. Главное, на мой взгляд, что в результате этот процесс должен принести пользу нашим пациентам. Кроме того, существует группа больных с ранней стадией НМРЛ, которым, к сожалению, противопоказано оперативное вмешательство; в настоящее время они и составляют основной контингент для проведения стереотаксической радиохирургии».

















