Статьи
Комбинированная иммунотерапия метастатического рака почки
Проблема почечно-клеточного рака (ПКР) актуальна не только из-за изменений в стандартах его лечения, но и из-за роста заболеваемости раком почки как в целом, так и в нашей стране. В 2020 году в России диагностировано более 20 тыс., а в мире – 431 288 новых случаев ПКР, причем, по оценкам ВОЗ, к 2040 году эта цифра может возрасти до 650 тыс. в год. Обнадеживает отчетливая тенденция к увеличению локализованных форм рака почки (64,2 %), но при этом вызывает тревогу тот факт, что примерно в 20 % случаев ПКР ежегодно регистрируется на IV стадии.
ИЗМЕНЕНИЕ СТАНДАРТОВ
В последние 15 лет наблюдается кардинальное изменение стандартов лекарственной терапии метастатического ПКР (мПКР), число случаев которого пополняется за счет прогрессирования заболевания после хирургического лечения локализованного рака почки. Иммунотерапию (ИТ) цитокинами в 2005 году заменили таргетные препараты. В последние годы в клиническую практику были внедрены иммуноонкологические препараты (ИОП) ниволумаб, пембролизумаб и CTLA-4 (ипилимумаб). Способные точечно блокировать межклеточную передачу противоиммуногенного сигнала, они ингибируют рецептор программируемой клеточной смерти 1-го типа (PD-1), благодаря чему демонстрируют существенные преимущества для пациентов. Однако добиться максимальной эффективности позволяет комбинированная лекарственная терапия. Сегодня ИОП одобрены к применению в комбинации с таргетными ингибиторами тирозинкиназ (ИТК). Поскольку их совместное использование уже стало текущим стандартом лечения, можно смело говорить о наступлении эры комбинированной иммунотерапии мПКР.
Ингибиторы контрольных точек иммунитета и тирозинкиназ не только подавляют рост опухоли за счет различных механизмов действия, но и потенцируют эффекты друг друга. Синергизм их действия заключается в более полной реализации Т-клеточно-опосредованной противоопухолевой активности за счет способности тирозинкиназного ингибитора устранять иммуносупрессию, обусловленную васкулоэндотелиальными факторами (VEGF). Антиангиогенные препараты могут восстанавливать дифференцировку дендритных клеток, снижать уровень миелоидных клеток-супрессоров и уровни регуляторных Т-клеток. Происходит нормализация васкуляризации опухоли и уменьшение гипоксии, что способствует увеличению Т-клеточной инфильтрации. Иными словами, ИТК устраняют препятствия на пути действия ингибиторов контрольных точек.
В России сегодня зарегистрированы к применению три комбинации препаратов: две иммунотаргетные (пембролизумаб + акситиниб, авелумаб + акситиниб) и одна двойная иммуноонкологическая комбинация (ниволумаб + ипилимумаб). Алгоритм выбора режима лекарственной терапии у пациентов с мПКР по национальным стандартам, одобренным Министерством здравоохранения РФ в 2021, представлен в таблице. Из нее следует, что во всех группах прогноза рекомендуются в первую очередь схемы комбинированного лечения. Следует обратить внимание на то, что комбинация ниволумаба с ипилимумабом рекомендуется только для пациентов группы плохого и промежуточного прогноза.
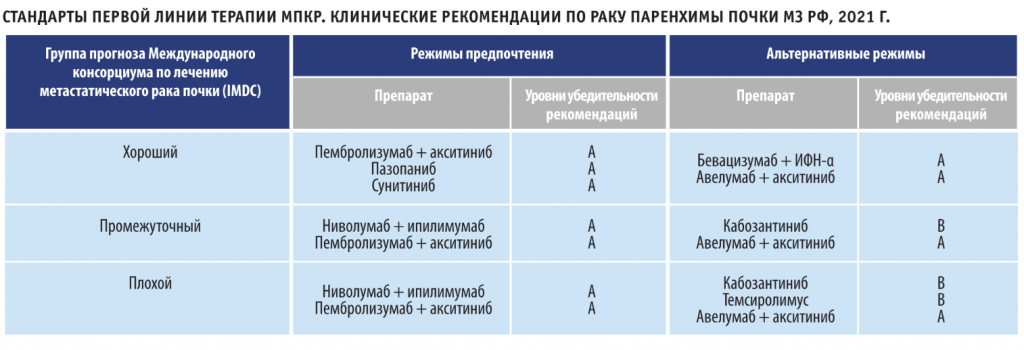
АНАЛИЗ РЕЗУЛЬТАТОВ
В регистрационном исследовании CheckMate-214 пациенты, не получавшие ранее терапию по поводу светлоклеточного мПКР, были рандомизированы в группу ниволумаба в комбинации с ипилимумабом (n = 550) или в группу сунитиниба (n = 546). Ниволумаб (3 мг / кг) назначался в комбинации с ипилимумабом (1 мг / кг) каждые 3 недели (всего 4 дозы), далее продолжалась терапия ниволума- бом (3 мг / кг каждые 2 недели). Сунитиниб пациенты получали в стандартном режиме — 4 / 2 в дозе 50 мг. Первичными конечными точками исследования были общая выживаемость (ОВ), выживаемость без прогрессирования (ВБП) и частота объективных ответов (ЧОО) в группе пациентов с промежуточным и плохим прогнозом.
Комбинация ниволумаба с ипилимумабом показала значимое увеличение ОВ пациентов по сравнению с сунитинибом в группе плохого и промежуточного прогноза. При наблюдении в течение 42 мес риск смерти снижался на 34 % при комбинированной терапии. В группе благоприятного прогноза терапия комбинацией препаратов не давала преимущества в ОВ по сравнению с использованием одного только сунитиниба, а ВБП оказалась даже выше на 10 месяцев при терапии сунитинибом. Преимущество ниволумаба в комбинации с ипилимумабом перед сунитинибом в ЧОО отмечалось также только в группе промежуточного и благоприятного прогноза (41,9 % против 26,8 %), а при благоприятном прогнозе объективные ответы чаще регистрировались при терапии сунитинибом.
Это значит, что при благоприятном прогнозе данная комбинация проигрывает таргетной терапии, так как, вероятно, в этом случае большее значение в развитии опухоли еще имеет ангиогенез, а не нарушение иммунного статуса. Наиболее частыми нежелательными явлениями (НЯ) 3–4-й степени, связанными с иммунотерапией, были повышение уровней липазы (10 %), амилазы (6 %) и аланинаминотрансферазы (АЛТ) (5 %), тогда как в группе сунитиниба чаще встречались гипертензия (17 %), усталость (10 %) и ладонно-подошвенный синдром (9 %). Частота всех нежелательных явлений 3–4-й степени составила 47 % и 64 % в группах ИТ и сунитиниба соответственно. Полная отмена терапии потребовалась 22 % пациентов в связи с невозможностью корректировки дозы ИОП. Важно отметить, что в данной комбинации ипилимумаб назначается в сниженной дозировке — 1 мг / кг. Таким образом, при более высокой эффективности комбинация ниволумаба и ипилимумаба приводит к развитию меньшего количества НЯ 3–4-й степени.
ПЕМБРОЛИЗУМАБ + АКСИТИНИБ
Иммунотаргетная комбинация пембролизумаб + акситиниб одобрена в первой линии терапии мПКР по результатам исследования III фазы KEYNOТE-426. В нем комбинация пембролизумаба с акситинибом (n = 432) сравнивалась с сунитинибом (n = 429) при мПКР у ранее не леченных пациентов. Пембролизумаб (по 200 мг в / в каждые 3 недели) назначался в комбинации с акситинибом (5 мг внутрь 2 раза в сутки) в течение 24 месяцев. Сунитиниб пациенты получали в стандартной дозе в режиме 4 / 2 Экспрессия PD-L1, не являвшаяся критерием исключения, отмечалась у 59,3 % больных в группе комбинации и у 61,7 % — в группе сунитиниба.
Комбинация пембролизумаба и акситиниба стала первым сочетанием препаратов, позволившим значительно улучшить ОВ, ВБП и ЧОО при мПКР по сравнению с терапией сунитинибом. Полученные различия были статистически значимы во всех прогностических подгруппах, включая группы низкого, среднего и высокого риска, независимо от экспрессии PD-L1.
Пембролизумаб в комбинации с акситинибом почти вдвое снижает риск смерти (на 47 %). По обновленным данным исследования KEYNOТE-426, представленным на конгрессе ASCO в 2021 году, комбинация пембролизумаба с акситинибом подтвердила статистически значимое увеличение ОВ, ВБП и ЧОО по сравнению с сунитинибом. Медиана наблюдения в данном протоколе уже составила 42,8 месяца. При терапии комбинацией препаратов ЧОО равнялась 60,4 % против 39,6 %, частота полных ответов — 10,0 % против 3,5 % при терапии сунитинибом (p <0,0001), а средняя длительность ответа при комбинированном лечении — 23,6 месяца.
При проведении анализа эффективности терапии в зависимости от группы прогноза IMDC показано, что пембролизумаб с акситинибом имеет выраженное преимущество в показателях ОВ, ВБП и ЧОО по сравнению с сунитинибом в группах промежуточного и плохого прогноза. При благоприятном прогнозе различия в ОВ и ВБП между группами сравнения практически отсутствуют, а ЧОО все же выше в группе комбинированного лечения на 18 % по сравнению с сунитинибом. Тем не менее данная комбинация не уступает в эффективности сунитинибу даже у пациентов с хорошим прогнозом и рекомендована в первой линии мПКР вне зависимости от группы риска в соответствии с протоколом Международного консорциума по лечению метастатического рака почки (IMDC): степень рекомендации — А. Что касается безопасности комбинированного лечения, то степень токсичности комбинации пембролизумаба и акситиниба была в целом приемлемой, хотя число НЯ оказалось все же выше, чем в группе сунитиниба. НЯ 3–5-й степени тяжести, связанные с терапией, были отмечены у 62,9 % из 429 пациентов в группе пембролизумаба и у 58,1 % из 425 пациентов в группе сунитиниба. НЯ, приведшие к прекращению какой-либо терапии, имели место у 25,9 % пациентов в группе комбинированной терапии пембролизумабом и у 10,1 % пациентов в группе сунитиниба. Наиболее частыми НЯ 3–5-й степени (отмеченными у ≥ 10 % пациентов) были гипертензия (22,1 %) и повышение уровня АЛТ (13,3 %) в группе комбинированной терапии пембролизумабом и акситинибом, а также гипертензия (19,3 %) в группе сунитиниба. Анализ обновленных данных, представленных на конгрессе ASCO 2021 года, показал сопоставимые результаты по профилю безопасности комбинации препаратов.
АКСИТИНИБ + АВЕЛУМАБ
Второй иммунотаргетной комбинацией, одобренной для применения в первой линии мПКР, стала комбинация акситиниба с авелумабом. Авелумаб представляет собой полностью человеческое моноклональное антитело против лиганда программируемой клеточной смерти 1 (PD-L1). Кроме Т-клеточного иммунного ответа авелумаб активирует механизмы врожденного иммунитета — антителозависимую клеточно-опосредованную цитотоксичность. Опосредуемый натуральными киллерами (NK) прямой лизис клетки опухоли достигается за счет наличия у авелумаба интактного участка Fc-гамма, который способен связываться с соответствующими рецепторами на NK.
Комбинация авелумаба с акситинибом одобрена для применения в первой линии терапии мПКР на основании результатов исследования III фазы JAVELIN Renal 101 В группе сравнения также использовался сунитиниб. Первичными конечными точками являлись ВБП и ОВ у пациентов с положительной экспрессией PD-L1, а ОВ, ВБП, ЧОО и другие показатели в общей популяции пациентов относились ко вторичным целям исследования, что было отличительной особенностью данного протокола. Считается, что экспрессия PD-L1 у больных мПКР ассоциирована с худшим прогнозом и снижением эффективности таргетной терапии. Но по результатам исследования отмечалась достоверно большая ВБП в группе комбинации авелумаба с акситинибом по сравнению с сунитинибом как в популяции больных с PDL+, так и в общей популяции пациентов.
По обновленным данным исследования, представленным на конгрессе ASCO в 2021 году, комбинация авелумаба с акситинибом продолжает демонстрировать значимое преимущество по показателю медианы ВБП в сравнении с сунитинибом (13,9 мес против 8,5 мес соответственно). Важно, что преимущество комбинации препаратов сохраняется вне зависимости от группы прогноза IMDC. В общей популяции ЧОО была почти в 2 раза выше в группе авелумаба и акситиниба, чем в группе сунитиниба (52,5 % и 27,3 % соответственно). В группе благоприятного прогноза преимущество в ЧОО при терапии комбинацией препаратов достигало 30 %.
Профиль безопасности данной комбинации очень похож на профиль комбинации пембролизумаба с акситинибом. Следует отдельно отметить низкую токсичность комбинации авелумаба с акситинибом. Она сопоставима с монотерапией сунитинибом при сравнении НЯ любой степени тяжести. Наиболее часто наблюдались диарея, артериальная гипертензия, слабость, ладонно-подошвенный синдром, гипотиреоз. Частота полной отмены терапии оказалась значительно ниже при терапии авелумабом и акситинибом (7,6 % против 13,4 %), а 10,8 % пациентов имели даже эскалацию дозы акситиниба. Таким образом, комбинация авелумаба и акситиниба показала значительные преимущества по сравнению с сунитинибом в не получавших ранее терапию когортах пациентов со светлоклеточным мПКР, как экспрессирующих PD-L1, так и вне зависимости от экспрессии PD-L1 и от группы прогноза IMDC.
Следовательно, комбинации ИОП с акситинибом демонстрируют отличные результаты терапии во всех группах прогноза первой линии терапии мПКР. Акситиниб не случайно выбран как ИТК для совмещения с ингибиторами контрольных точек иммунитета. Ранее ингибиторы контрольных точек пробовали сочетать с сунитинибом и пазопанибом, но исследования были завершены досрочно из-за высокой токсичности этих схем.
ВТОРОЕ ПОКОЛЕНИЕ
В исследованиях KEYNOТE-426 и JAVELIN Renal 101 пембролизумаб, авелумаб и акситиниб использовались в стандартных дозировках. Для акситиниба возможна эскалация дозы до 7 или 10 мг под контролем артериального давления. Комбинации с акситинибом менее токсичны за счет его селективности ингибирования рецепторов VEGFR 1, 2 и 3-го типов. Акситиниб — мощный ИТК второго поколения, который используется уже около 10 лет. Его эффективность в 50–450 раз выше, чем у ингибиторов VEGFR первого поколения.
Акситиниб блокирует рецепторы VEGFR в субнаномолярных дозах препарата. Более высокая токсичность комбинаций с ингибиторами VEGFR первого поколения объясняется тем, что они блокируют и другие мишени, например рецепторы фактора роста тромбо- цитов PDGFR и другие тирозинкиназы (b-Raf, KIT и FLT-3), которые не подавляет акситиниб. Эта нежелательная активность влияет на профиль токсичности ИТК первого поколения, и, вероятно, более селективные ингибиторы рецепторов VEGFR, такие как акситиниб, могут иметь более высокую эффективность.
Таким образом, три лекарственных комбинации с ингибиторами контрольных точек одобрены к применению в нашей стране и рекомендованы стандартами Минздрава РФ в 2021 году. Каждая комбинация препаратов имеет наивысшую степень рекомендации и обладает более высокой эффективностью по сравнению с таргетной монотерапией сунитинибом. Комбинации с акситинибом могут применяться у всех пациентов вне зависимости от группы прогноза IMDC, а комбинация двух ИОП — ниволумаба и ипилимумаба — только у пациентов из группы промежуточного и неблагоприятного прогноза. Место ИТК сунитиниба и пазопаниба сохраняется в рекомендациях только в группе благоприятного прогноза.
Несмотря на использование комбинированной лекарственной терапии, токсичность схем с акситинибом сопоставима с монотерапией сунитинибом за счет большей селективности акситиниба. Токсичность двойной иммунотерапевтической комбинации отличается по спектру НЯ от таргетной терапии, но также весьма умеренна за счет применения ипилимумаба в редуцированной дозировке. Все препараты, используемые в вышеперечисленных комбинациях, зарегистрированы в нашей стране и доступны для применения.
Анна Маркова, к.м.н.
Читайте также
- Мы снова всех опередили, но вот в чем?
- Новые возможности лечения больных неметастатическим кастрационно- резистентным раком предстательной железы
- Хавьер Кортес: о новых трендах и лечении рака молочной железы в Испании
- Московский онкологический форум — знаковое событие столичного здравоохранения
- «Мы здесь не из-за денег». Медицина в XXI веке: бизнес или предназначение?
- Генетическая панель РАМ-100 — новая идеология в молекулярной диагностике рака молочной железы
- Первичная профилактика фебрильной нейтропении при химиотерапевтическом лечении
- Эффективность моноклонального антитела пролголимаб при терапии метастатической меланомы: клиническое исследование MIRACULUM

















