Статьи
Нервосберегающая радикальная простатэктомия: как минимизировать онкологические риски?
Использование нервосберегающей техники радикальной простатэктомии является единственным эффективным способом сохранения эректильной функции у больных раком простаты после операции. Презервация сосудисто-нервных пучков всегда предполагает определенный компромисс между максимально возможной радикальностью операции и обеспечением оптимальных функциональных результатов и качества жизни пациентов. В данном материале представлены наиболее эффективные методики, повышающие онкологическую безопасность нервосбережения и позволяющие расширить показания к его выполнению.
Радикальная простатэктомия остается одним из основных методов лечения больных раком предстательной железы. Однако, согласно отдаленным результатам масштабных рандомизированных исследований, оценивающих эффективность и безопасность радикальной простатэктомии в сравнении с различными вариантами выжидательной тактики (SPCG‑4, PIVOT, ProtecT), значимый выигрыш от хирургического лечения большинство пациентов получают лишь через десятилетия после операции при большей частоте побочных эффектов в отношении мочевой и сексуальной функций. Это привело к существенному увеличению частоты использования активного наблюдения при раке предстательной железы низкого риска, в то время как оперативное лечение стало чаще использоваться в группах промежуточного и высокого риска, а также при местнораспространенном процессе.
 При проведении условной аналогии между исходами радикальной простатэктомии и пирамидой потребностей Маслоу отсутствие рецидива соответствует наиболее базовой потребности — безопасности, а сохранение эректильной функции находится ближе к вершине (рис. 1). Тем не менее послеоперационное нарушение сексуальной функции имеет существенное негативное влияние на качество жизни больных, а в контексте имеющихся тенденций к выполнению операции при более агрессивных характеристиках опухоли на первый план выходит онкологическая безопасность нервосбережения, достижение которой возможно за счет предоперационной селекции пациентов и интраоперационной оценки клинической ситуации. Интересно, что к настоящему времени не определены однозначные показания к использованию нервосберегающей техники: так, клинические рекомендации Европейской ассоциации урологов ограничиваются общим заключением не использовать нервосбережение при высоком риске ипсилатеральной экстракапсулярной экстензии опухоли без уточнения конкретных критериев.
При проведении условной аналогии между исходами радикальной простатэктомии и пирамидой потребностей Маслоу отсутствие рецидива соответствует наиболее базовой потребности — безопасности, а сохранение эректильной функции находится ближе к вершине (рис. 1). Тем не менее послеоперационное нарушение сексуальной функции имеет существенное негативное влияние на качество жизни больных, а в контексте имеющихся тенденций к выполнению операции при более агрессивных характеристиках опухоли на первый план выходит онкологическая безопасность нервосбережения, достижение которой возможно за счет предоперационной селекции пациентов и интраоперационной оценки клинической ситуации. Интересно, что к настоящему времени не определены однозначные показания к использованию нервосберегающей техники: так, клинические рекомендации Европейской ассоциации урологов ограничиваются общим заключением не использовать нервосбережение при высоком риске ипсилатеральной экстракапсулярной экстензии опухоли без уточнения конкретных критериев.
Роль МРТ в селекции пациентов для нервосбережения
Несмотря на постоянное развитие методик визуализации и биопсии предстательной железы, послеоперационная частота миграции стадии до местнораспространенного процесса и частота повышения гистологической градации опухоли остаются весьма высокими, а использование нервосберегающей техники в таком случае может существенно повышать риск позитивного хирургического края и, следовательно, рецидива опухоли.
Ключевым аспектом отбора пациентов является мультипараметрическая МРТ (мпМРТ), однако результаты ее эффективности в отношении прогнозирования экстракапсулярной экстензии пока неоднозначны. По данным S. Mehralivand et al., лучшая диагностическая точность наблюдается при совместном применении мпМРТ и клинических характеристик рака предстательной железы. В исследовании F. Pesapane et al. описаны ранние и поздние признаки экстракапсулярной экстензии при мпМРТ. К ранним относятся выпячивание капсулы простаты, протяженность и близость контакта опухолевого очага с капсулой и ее нечеткость, к поздним — неровный контур простаты, инфильтрация околопростатической жировой клетчатки, облитерация ректопростатического угла, наличие перипростатической опухолевой массы. По данным авторов, ранние признаки встречаются существенно чаще, при этом, по понятным причинам, обладают низкой прогностической ценностью в сравнении с поздними признаками. В целом использование мпМРТ в рамках подготовки и планирования радикальной простатэктомии позволяет обеспечивать потенциально высокую степень персонализации оперативного вмешательства в зависимости от анатомии пациента и опухолевых характеристик. Например, в исследовании R. Schiavina et al. данные мпМРТ привели к изменению плана операции в 46,7 % случаев и снижению частоты позитивного хирургического края (12,4 % против 24,1 % в контрольной группе; p < 0,01). Согласно H.H. Tavukçu et al., мпМРТ изменила план операции в пользу применения нервосбережения у 56 % больных, что не сопровождалось увеличением частоты положительного хирургического края.
Калькуляция риска (номограммы)
В контексте принятия решения о нерво-сберегающей технике радикальной простатэктомии принципиальное значение могут иметь номограммы, способные прогнозировать риск экстракапсулярной экстензии со стороны сохранения пучка. Наиболее известные номограммы — MSKCC и таблицы Партина оценивают лишь общую вероятность экстензии и не предоставляют четких критериев оценки риска нервосберегающей техники с конкретной стороны. Предложенная V.R. Patel et al. номограмма PRECE позволяет оценивать и градировать риск экстензии в правой и левой долях простаты, однако не предполагает интеграции данных мпМРТ. Вероятно, максимальная эффективность комбинации клинических параметров и данных мпМРТ возможна при изначальной разработке номограммы, включающей эти характеристики. Так, J. Nyarangi-Dix et al. показали, что сочетанное использование мпМРТ и клинических характеристик в рамках разработанной ими номограммы обеспечивает более высокую точность прогноза наличия выхода опухоли за пределы капсулы с определенной стороны простаты и оптимизирует планирование радикальной простатэктомии с нервосбережением. Разработанная на основании опыта двух ведущих мировых клиник номограмма Martini, помимо основных клинических параметров, включает в анализ подозрение на экстракапсулярную экстензию, по данным мпМРТ и, по мнению авторов, позволяет осуществлять градацию пациентов в зависимости от риска экстензии для выполнения определенной степени нервосбережения.
В то же время, по данным сторонней оценки (валидации) и анализа эффективности, большинство предложенных номограмм не обеспечивают необходимую точность в отношении прогнозирования экстензии рака простаты в группе пациентов, отличающейся от группы, на которой алгоритм был непосредственно разработан. Следует отметить и другие потенциальные проблемы использования номограмм в реальной клинической практике, а именно: необходимость временных затрат, большое количество разработанных алгоритмов при отсутствии однозначных преимуществ той или иной номограммы, отсутствие ясных клинических рекомендаций по использованию номограмм, возможное отсутствие всех необходимых клинических характеристик для расчета и, самое главное, низкую дополнительную ценность использования в «серой зоне» при промежуточном риске экстензии опухоли, поскольку пограничные случаи низкого и высокого риска и так зачастую являются очевидными.
Интраоперационный гистологический контроль края резекции
Возможным направлением снижения онкологических рисков нервосберегающей радикальной простатэктомии является интраоперационный контроль состояния хирургического края резекции: предложенная T. Schlomm et al. методика срочного гистологического исследования прилегающих к сосудисто-нервным пучкам участков простаты (NeuroSAFE) позволяет осуществлять резекцию ткани пучка со стороны выявленного при интраоперационном исследовании положительного хирургического края. Согласно проспективному исследованию G. Mirmilstein et al., внедрение методики NeuroSAFE в протокол выполнения робот-ассистированной радикальной простатэктомии привело к снижению позитивных краев с 17,8 до 9,2 % (p = 0,04) при значимом увеличении частоты нервосбережения при стадии pT2 (84,6 и 66,3 %; p = 0,002) и pT3 (65,1 и 36,7 %; p = 0,012). По данным F. Preisser et al., использование интраоперационной оценки замороженных срезов увеличило сохранение пучков с 55,3 до 95,5 % (p < 0,001) при снижении частоты положительного края с 29,5 до 15,4 % (p = 0,003).

Стандартная методика NeuroSAFE предполагает оценку 7–10 поперечных участков боковой поверхности простаты шириной 5 мм. Данные участки располагаются от апекса к базису, замораживаются в криостате, после чего осуществляются срезы толщиной около 5 мкм, которые окрашиваются гематоксилином и эозином. По мнению J. Oxley et al., адаптация и применение принципов микрографической хирургии («золотой стандарт» при хирургическом лечении новообразований на коже лица в дерматологии) в рамках срочного гистологического исследования краев простаты может снизить время и стоимость методики NeuroSAFE, позволив осуществлять более полную оценку хирургического края. На этих принципах основана наша собственная методика ЦИКЛОП — cito-исследование края латерального области простаты (рис. 2). Ее особенностью является окраска и выполнение криосрезов прилегающей к пучкам заднебоковой области простаты единым блоком, что позволяет оценивать всю площадь контакта железы с сосудисто-нервным пучком без необходимости дополнительной вырезки препарата, опре- делять точную локализацию позитивного хирургического края и оптимизирует время выполнения исследования. После удаления и извлечения предстательной железы вырезается участок ткани, включающий всю заднебоковую область, прилегающую к пучку, для ориентации наружная поверхность подготовленного участка ткани окрашивается в оранжевый цвет в зоне апекса и в темно-синий — в зоне базиса. Далее образец замораживается, после чего осуществляются срезы наружной поверхности толщиной 7–9 мкм, которые затем фиксируются на предметном стекле, окрашиваются гематоксилин-эозином и исследуются под микроскопом. Параллельно с выполнением методики ЦИКЛОП формируется анастомоз между мочевым пузырем и уретрой, при наличии показаний выполняется расширенная тазовая лимфаденэктомия, что исключает увеличение продолжительности оперативного вмешательства. После получения информации о негативном статусе хирургическая операция завершается. При наличии позитивного края выполняется резекция сохраненного сосудисто-нервного пучка. Использование методики ЦИКЛОП в нашей серии нервосберегающих простатэктомий привело к снижению частоты позитивного хирургического края с 13 до 4 % при использовании нервосбережения, в том числе при раке простаты высокого риска. Крайне важным дополнительным положительным аспектом использования интраоперационного гистологического контроля края резекции, который трудно поддается оценке в рамках научных исследований, является психологический комфорт хирурга и пациента при выполнении нервосбережения в пограничных случаях, возможность для хирурга разделить ответственность и обосновать принятое решение.
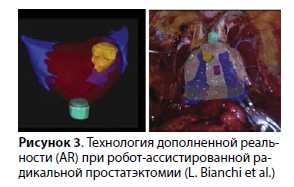
Будущее интраоперационной навигации нервосбережения
Согласно работе L. Bianchi et al., интеграция робот-ассистированной радикальной простатэктомии с методикой создания изображений трехмерной дополненной реальности (AR) позволяет путем наложения капсулы простаты и очага опухоли, по данным мпМРТ, точно определять локализацию поражения и корректировать слой диссекции во время операции (рис. 3). В то же время эффективность данной технологии напрямую зависит от диагностической точности предоперационной мпМРТ и не может подтвердить радикальный характер операции на микроскопическом уровне. Таким образом, методика при дальнейшем развитии способна выступать в качестве условного навигатора при выполнении операции, но не позволит однозначно исключить инвазию опухоли в те или иные структуры.
 В качестве альтернативы классическому срочному гистологическому исследованию изучается методика конфокальной лазерной микроскопии, которая позволяет получать ex vivo или in vivo изображения простатической и околопростатической ткани, схожие и коррелирующие со стандартными гистологическими изображениями (рис. 4). В случае исследования ex vivo удаленная ткань не требует дополнительной обработки и может изучаться в режиме реального времени, а получаемые изображения являются практически идентичными гистологическим слайдам с окраской гематоксилином и эозином. Это делает данную методику перспективной в отношении срочной оценки окружающей сосудисто-нервные пучки ткани при радикальной простатэктомии с нервосберегающей техникой. Методика in vivo конфокальной лазерной эндомикроскопии, позволяющей оценить состояние тканей с помощью зонда, введенного в операционное поле непосредственно во время диссекции, в теории является даже более интересной технологией, однако в настоящее время клинические исследования in vivo указывают на ее низкую эффективность вследствие недостаточной глубины проникновения и очевидных трудностей в интерпретации черно-белых изображений при оценке капсулы простаты.
В качестве альтернативы классическому срочному гистологическому исследованию изучается методика конфокальной лазерной микроскопии, которая позволяет получать ex vivo или in vivo изображения простатической и околопростатической ткани, схожие и коррелирующие со стандартными гистологическими изображениями (рис. 4). В случае исследования ex vivo удаленная ткань не требует дополнительной обработки и может изучаться в режиме реального времени, а получаемые изображения являются практически идентичными гистологическим слайдам с окраской гематоксилином и эозином. Это делает данную методику перспективной в отношении срочной оценки окружающей сосудисто-нервные пучки ткани при радикальной простатэктомии с нервосберегающей техникой. Методика in vivo конфокальной лазерной эндомикроскопии, позволяющей оценить состояние тканей с помощью зонда, введенного в операционное поле непосредственно во время диссекции, в теории является даже более интересной технологией, однако в настоящее время клинические исследования in vivo указывают на ее низкую эффективность вследствие недостаточной глубины проникновения и очевидных трудностей в интерпретации черно-белых изображений при оценке капсулы простаты.
Заключение
В настоящий момент невозможно выделить единые однозначные показания и противопоказания к нервосберегающей технике. Принятие решения о сохранении сосудисто-нервных пучков с одной или обеих сторон требует комплексной индивидуальной оценки клинической ситуации.
Читайте также
- 41-й конгресс SIU: место встречи — Дубай
- Стриктуры уретры у женщин в практике реконструктивного уролога
- Трансплантация почки от донора, инфицированного COVID‑19 первые известные наблюдения и выводы были сделаны в России
- Классификации мочевых камней — взгляд эндоуролога
- Возможности растительной фармакотерапии в лечении рецидивирующих инфекций мочевыводящих путей и профилактике эпизодов цистита
- Инфекции нижних мочевых путей у женщин
- Стентирование у беременных: показания и контраверсии

















