Статьи
Прошлое, настоящее и будущее цистоскопии
Цистоскопия представляет собой рутинную урологическую процедуру, имеющую множество показаний к применению. Несмотря на кажущуюся легкость, отступление от принципов ее выполнения и протоколирования ведет к снижению диагностической ценности, может причинить значительные неудобства и даже вред больному. Принципиально важно подходить к этой манипуляции с соблюдением всех правил для достижения наилучшего результата исследования и оптимального комфорта пациентов.
С чего все начиналось
Возникновение методики цистоскопии относится к началу XIX в., когда предпринимались первые попытки сконструировать прибор для осмотра мочевого пузыря без открытого вмешательства. Немецким врачом Филиппом Боццини (P. Bozzini) было изготовлено приспособление, позволявшее осматривать матку, прямую кишку и мочевой пузырь. Оно было основано на использовании отраженного света свечи и получило название «световод». Позднее Максимилиан Нитце (M. Nitze) и Йозеф Лейтер (J. Leiter) сформулировали главные принципы, которые легли в основу конструкции цистоскопа. В 1879 г. авторы представили собственный цистоскоп на заседании Венского общества врачей. Гибкий фиброскоп для осмотра шейки мочевого пузыря впервые использовали Сейги Цушида (S. Tsuchida) и Хирояцу Сугавара (H. Sugawara) полвека назад, а широкое применение этого инструмента в урологической практике началось с 1980-х гг.
На сегодняшний день урологу доступен обширный арсенал неинвазивных методов диагностики заболеваний нижних мочевых путей (НМП): рентгенологических, ультразвуковых, цитологических, молекулярно-генетических и др. Все они имеют достаточно высокую чувствительность, но по специфичности значительно уступают цистоскопии и не могут полностью заменить ее. Когда нужно проводить? Учитывая инвазивный характер цистоскопии, в первую очередь необходимо охарактеризовать четкие показания к ее назначению. К основным клиническим ситуациям, в которых проведение исследования обосновано, относятся:
- гематурия;
- рецидивирующие инфекции НМП (вне обострения);
- синдром хронической тазовой боли;
- обструктивные/ирритативные симптомы НМП;
- атипичная картина при цитологическом исследовании мочи;
- атипичная картина состояния мочевого пузыря и НМП по данным радиологических методов;
- верифицированные запущенные онкогинекологические/онкоколопроктологические процессы для исключения инвазии опухоли в мочевой пузырь;
- аномалии развития мочевой системы;
- наблюдение пациентов после перенесенной трансуретральной резекции (ТУР) мочевого пузыря по поводу немышечно-инвазивного рака органа (НМИРМП).
Антибиотикопрофилактика— дополнительный риск
Выполнение цистоскопии на фоне острой инфекции мочевыводящих путей (ИМВП) само по себе неоднозначно и может привести к септическим осложнениям. Известно, что одной из глобальных проблем здравоохранения в целом является антибиотикорезистентность микроорганизмов, в подавляющем большинстве случаев обусловленная нерациональной антибиотикотерапией. Согласно актуальным клиническим рекомендациям, перед амбулаторной цистоскопией антибактериальная профилактика не является необходимой.
Она не должна применяться у пациентов без клинических признаков острой ИМВП и с бессимптомной бактериурией ввиду кратковременности вмешательства, «смыва» патогенов при самостоятельном мочеиспускании после процедуры, а также с учетом собственной антиадгезивной активности слизистой оболочки (СО) мочевого пузыря. В то же время, несмотря на малую инвазивность цистоскопии, ни в коем случае нельзя забывать о строгом соблюдении общих правил асептики и антисептики при организации работы цистоскопического кабинета и непосредственно в ходе манипуляции.
Комфортная цистоскопия: миф или реальность?
Одна из основных задач уролога при проведении цистоскопии помимо тщательной оценки состояния НМП — минимизация психологического и физического дискомфорта пациента до вмешательства, во время и после него. Выбор инструмента во многом определяется техническим оснащением и возможностями лечебного учреждения.
Существует 2 типа цистоскопов: гибкий (фиброцистоскоп) и ригидный. Выполнение исследования возможно с применением местной анестезии и/или внутривенной седации. Жесткая цистоскопия может рутинно применяться под местной анестезией у женщин ввиду анатомических особенностей уретры. Для амбулаторной процедуры с гибким инструментом достаточно местного обезболивания, которое достигается введением в мочеиспускательный канал геля-лубриканта с лидокаином и его экспозицией в течение 2–5 мин. Уменьшить дискомфорт при прохождении инструментом наиболее суженной части канала (мембранозного отдела) удается путем увеличения интенсивности потока ирригационной жидкости при сдавлении ассистентом либо медицинской сестрой емкости с физиологическим раствором. Эта прием несложен на практике и доказал свою эффективность в клинических исследованиях, будучи включен в клинические рекомендации.
По данным E.Gezginci и соавт., как и целого ряда других авторов, высокоэффективными в плане уменьшения болевых ощущений и беспокойства могут быть методы дистракции (отвлечения внимания) пациента во время цистоскопии. Сюда можно отнести просмотр фильмов, использование антистресс-игрушек, прослушивание музыки и т. д. Все эти методики просты и не требуют особых усилий для внедрения в рутинную практику, позволяя при этом существенно уменьшить неприятные ощущения в процессе исследования.
В случаях, когда необходимо применение ригидного инструмента для осуществления резекции мочевого пузыря, цистолитотрипсии, при отсутствии фиброскопа, а также на фоне аллергической реакции на лидокаин в анамнезе целесообразно прибегнуть к внутривенной седации.
В «новом свете»
Все пациенты с НМИРМП после лечения попадают в группу динамического наблюдения, основой которого является выполнение периодических контрольных цистоскопий. Необходимо также помнить, что карцинома in situ (CIS) проявляется у 10–20 % больных первичным раком мочевого пузыря (РМП) и может быть визуализирована только цистоскопически. Исследование в белом свете служит «золотым стандартом» диагностики этого заболевания, однако имеет свои недостатки. Несмотря на его отличную чувствительность при выявлении папиллярных новообразований, CIS и опухоли малых размеров могут быть легко пропущены урологами из-за неоптимальной визуализации. Это ведет к неправильной интерпретации результатов, несвоевременной постановке диагноза, прогрессированию заболевания, а также проведению неполной ТУР.
К основным доступным в настоящее время способам оптимизации цистоскопической картины относятся узкоспектральная визуализация (NBI) и использование фотодинамической диагностики — фотодинамическая сенсибилизация (PDD).
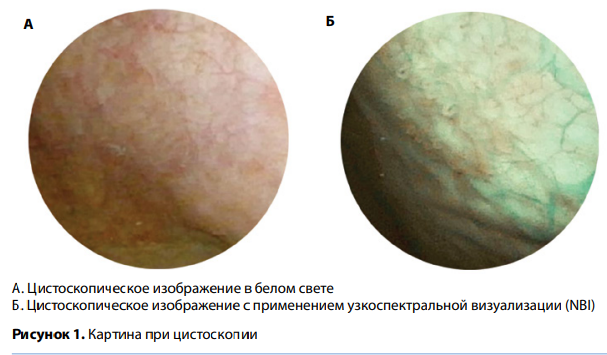
В основе NBI лежит сужение белого света до лучей 2 длин волн — соответствующих синему (415 нм) и зеленому (540 нм) свету — с помощью специального фильтра. Как известно, структура опухоли характеризуется увеличенным количеством питающих ее сосудов (неоангиогенез), что имеет вспомогательное значение при диагностике с NBI, особенно при опухолях малого размера. Гемоглобин избирательно поглощает волны синего и зеленого света, и это в свою очередь позволяет улучшить контраст между патологической и неизмененной тканью (рис. 1). A. Naselli и соавт. провели сравнительный анализ 7 исследований у 1040 пациентов и пришли к выводу, что применение NBI выявило на 24 % больше опухолей, чем цистоскопия в белом свете, при сравнимой частоте ложноположительных результатов. Таким образом, NBI улучшает диагностические и лечебные возможности метода, являясь неинвазивной в отличие от фотодинамической сенсибилизации.
Методика PDD основана на инстилляции 5-аминолевулиновой кислоты или ее гексилового эфира (Hexvix) в мочевой пузырь. Метаболиты этих соединений активно захватываются опухолевыми клетками и при попадании на них синего света дают красное свечение. ИсследованияG. Mowatt и соавт. показали, что эффективность метода для обнаружения неопластических образований 92 %, в то время как цистоскопии в белом свете— 71 %. Однако PDD в значительной степени уступает последней по специфичности: 57 против 72 % соответственно. Следовательно, для достижения лучшего результата рекомендуется их комбинация.
Несмотря на потенциальные преимущества PDD, в реальной клинической практике они могут быть минимальными. По данным рандомизированного исследовательского протокола PHOTO, представленного на конгрессе Европейской ассоциации урологов EAU 2023, не отмечено различий в частоте рецидивов в течение 3 лет после первичной ТУР с использованием PDD или белого освещения при очевидной большей стоимости фотодинамической диагностики.
Протоколирование: значение преемственности
Нередки ситуации, когда данные протокола амбулаторной цистоскопии не совпадают с фактической клинической картиной. R. Suarez-Ibarrola и соавт. в рамках опроса практикующих урологов показали, что только каждый пятый из них оценивает совпадение данных цистоскопического протокола с реальной картиной как полное. Остальные специалисты отмечают значительные пробелы в передаче информации от амбулаторного звена до стационара. Проблема в первую очередь связана непосредственно с протоколом исследования, который носит лишь текстовый описательный характер — в 52 % случаев отсутствует стандартизированная документация на основе видео- или фотоизображений.
В клинической практике оператору необходима информация о количестве новообразований, их размере, локализации и т. д., а также о состоянии других участков измененной СО. Эти данные имеют принципиальное значение в планировании предстоящего лечения. Они исключают необходимость повторной цистоскопии перед операцией, что позволяет уменьшить риски инфекционных осложнений и кровотечения из шейки мочевого пузыря за счет сокращения времени оперативного вмешательства и устранения лишних вхождений в полость органа из-за замены инструментов.
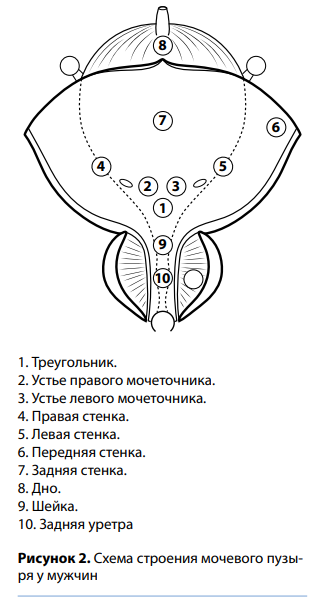
Протоколирование начинают с описания емкости мочевого пузыря, расположения и вида устьев мочеточников, наличия выброса мочи. Далее переходят к поэтапному описанию состояния СО всех стенок пузыря. Рационально использовать общепринятую схему, представленную в клинических рекомендациях Европейской ассоциации урологов (EAU) (рис. 2). При выявлении новообразования обязательно описывают все его макроскопические характеристики (локализация, размер, количество и внешний вид). Также необходимо дать описание и оценку состояния СО уретры, что важно для выбора лечебной тактики.
В целях большей информативности и лучшей преемственности в лечении пациентов, юридической защиты врачей может (и в идеале—должно) применяться фото- или видеопротоколирование цистоскопии. Современные цистоскопические стойки оснащены возможностью записи хода исследования на электронные носители с последующей беспроводной передачей изображений на любое устройство.
Настоящее и будущее диагностики
К недостаткам повсеместно используемого оборудования можно отнести проводной характер подключения, что требует порой бо́льших затрат времени, чем непосредственно проведение цистоскопии. Большое количество проводов диктует необходимость использования стерильных чехлов, стерилизации дополнительных компонентов (что удорожает исследование) и наряду с этим увеличивает риск микробной контаминации операционного поля. Кроме того, провода могут спутываться и занимать рабочее пространство, затрудняя тем самым работу оператора, а также повышать вероятность возгорания.
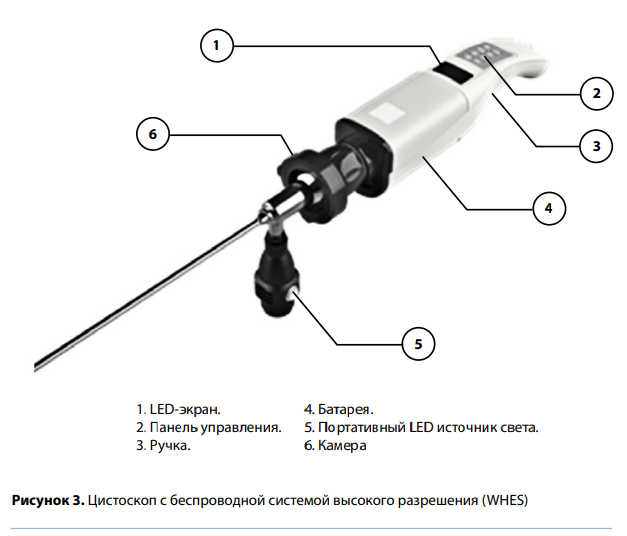
В литературе представлены данные о применении одной из новейших разработок — беспроводной эндоскопической системы высокого разрешения (WHES) (рис. 3). Она объединяет положительные качества традиционных эндоскопов, не уступая им по качеству изображения/ цветопередаче, и помогает преодолеть имеющиеся недостатки. Беспроводное подключение и передача полученных изображений на любой вид электронных девайсов решают множество проблем, связанных с перечисленными техническими трудностями, и облегчают протоколирование результатов.
Интерпретация данных процедуры во многом зависит от опыта и навыков хирурга. Частота ошибочных диагнозов при исследовании в белом свете достигает 30 %, а зарегистрированная частота неполных ТУР — 50 %, что способствует ранним рецидивам и прогрессированию РМП. Опубликованы данные ретроспективного анализа, подтверждающие, что выполненная менее опытными урологами ТУР мочевого пузыря сопровождается более высокой частотой ранних рецидивов заболевания. В дополнение к этому новообразования малого размера и CIS могут быть легко пропущены даже при наличии у специалиста достаточного опыта. Внедрение искусственного интеллекта (ИИ) для анализа цистоскопической картины способно помочь преодолеть несовершенства диагностики и лечения, обусловленные человеческим фактором. Коллегами из Китая опубликованы данные мультицентрового диагностического исследования, в котором сравниваются возможности ИИ и заключения опытных урологов в отношении анализа изображений, получаемых при цистоскопии. Разработана и протестирована диагностическая система ИИ (CAIDS) в рамках диагностики РМП. Применение этого алгоритма позволило достичь почти идеальной точности, чувствительности и специфичности во всех наборах внутренней и внешней проверки.
Для идентификации сложных карцином мочевого пузыря, таких как CIS и опухолевых образований очень малого размера, CAIDS показала лучшие диагностические результаты. Время, затраченное ИИ на оценку клинической ситуации и постановку диагноза, было равным 12 с, что значительно меньше необходимого даже для опытных врачей. Это обусловлено тем, что ИИ может автоматически извлекать микроструктуры изображений и идентифицировать их на уровне пикселей, не различимых человеческим глазом, а также обладает большой базой данных — значительным «опытом», особенно в сравнении с молодыми специалистами. Безусловно, время самостоятельной работы ИИ еще не пришло, однако дальнейшие проспективные клинические исследования в этой области могут существенно изменить нынешние подходы к диагностической цистоскопии.
***
Цистоскопия — незаменимая опция в диагностике заболеваний НМП, включая РМП. Манипуляция не представляет значительных технических сложностей, однако лишь при грамотной подготовке и учете множества небольших, но важных деталей она будет комфортной и «качественной» процедурой XXI века, а не испытанием для пациента.
Список литературы находится в редакции

















