Статьи
Таргетная терапия BRAF-позитивных глиом низкой злокачественности на фоне нежелательных явлений
В статье представлен успешный опыт применения таргетной терапии у детей с BRAF-позитивными глиомами низкой степени злокачественности (ГНСЗ), несмотря на развитие нежелательных явлений (НЯ) на фоне проводимого лечения.
В основе патогенеза ГНСЗ лежит активация сигнального пути MAPK. Ее причиной во многих случаях служит мутация BRAF V600E—универсальный драйвер многих злокачественных новообразований (ЗНО), включая кожную меланому и колоректальный рак. При локализации опухоли в срединных структурах (ствол головного мозга, таламусы, хиазмально-селлярная область) данная мутация встречается с частотой до 30 %. Это фактор неблагоприятного прогноза, определяющий плохой ответ на стандартные режимы химиолучевой терапии, а также риск трансформации ГНСЗ в глиомы высокой степени злокачественности.
Использование таргетной терапии (BRAF- ± MEK-ингибиторы) считается эффективной опцией у пациентов с данной мутацией. Частота объективных ответов на таргетную терапию больных c BRAF-позитивными ГНСЗ составляет 80 %, а на стандартную химиотерапию—лишь 28 %.
Развитие НЯ в ряде случаев диктует необходимость модификации таргетной терапии (снижения дозы либо полной отмены препаратов), что может негативно отразиться на ответе на лечение. Спектр НЯ на фоне применения таргетных препаратов довольно широк. Одна из наиболее частых реакций (более 10 %) — развитие лихорадки. Это не только требует модификации специфического лечения, но и негативно сказывается на качестве жизни пациентов. При использовании ряда молекулярно-направленных препаратов описана выраженная прибавка массы тела, что также иногда требует модификации проводимой терапии на основании критериев CTCAE.
ПРИМЕРЫ ИЗ ПРАКТИКИ
Случай 1.
У девочки (9 лет 11 месяцев) заболевание манифестировало судорожным синдромом. Во время МРТ визуализирована опухоль правой височной доли головного мозга. Выполнено тотальное удаление опухоли. Гистологически верифицирована плеоморфная ксантоастроцитома. Специфическая терапия не проводилась, только противосудорожная.
Через 4 года 8 месяцев после удаления опухоли у девочки участились эпилептические приступы. Контрольная МРТ выявила диссеминацию опухолевого процесса в головном мозге, кистоподобные новообразования в шейном отделе спинного мозга, окклюзионную гидроцефалию. Опухолевые образования в области водопровода мозга частично удалили с одновременным устранением окклюзии ликворных путей. Гистологическое заключение: «Десмопластическая инфантильная ганглиоглиома, WHO grade 1, BRAF V600E-позитивная».
В течение 19 месяцев после повторной операции проводилось динамическое наблюдение, в ходе которого выявлено прогрессирование заболевания (рост опухоли в области парагиппокампальной извилины справа и латеральной поверхности правой ножки мозга, увеличение объема патологического накопления контрастного вещества по оболочкам мозга).
Была инициирована комбинированная таргетная терапия (траметиниб и дабрафениб). На ее ранних сроках отмечались плохо контролируемая лихорадка до 40 °C, судороги, выраженная и стойкая гипонатриемия, в связи с чем таргетная терапия была временно приостановлена (на 7 дней). При обследовании данных за инфекционный процесс нет. Назначено сопроводительное лечение: инфузионная терапия, антипиретики, кратковременный курс глюкокортикостероидов (ГКС), коррекция гипонатриемии с положительной динамикой.
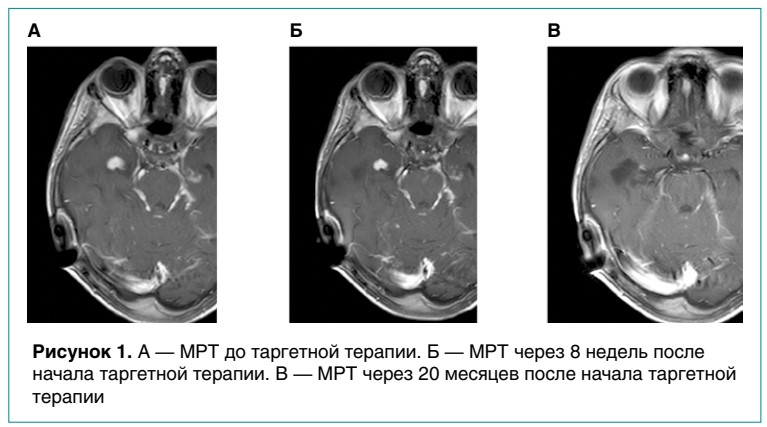
В связи с тяжелой переносимостью комбинации BRAF- и МЕК-ингибиторов и с учетом данных литературы принято решение о назначении BRAF-ингибитора (дабрафениб) в монорежиме. Переносимость терапии дабрафенибом удовлетворительная, повторных эпизодов гипертермии не отмечалось. По данным МРТ в динамике, на фоне таргетной терапии зафиксирован частичный ответ (рис. 1). На сегодня лечение дабрафенибом продолжается 26 месяцев. Ответ на него сохраняется.
Случай 2.
У девочки (7 лет 3 месяца) появились жалобы на снижение зрения, при осмотре глазного дна выявлены застойные полнокровные сосуды. При МРТ визуализируется объемное кистозно-солидное образование передней и средней черепной ямки с распространением на хиазмальную область и третий желудочек.
По месту жительства проводилась химиотерапия по схеме винкристин/карбоплатин (9 недель) со стабилизацией заболевания, после чего опухоль частично удалили. Гистологическое заключение: астроцитома, WHO grade 1. В последующем специфического лечения не проводилось, ребенок находился под наблюдением невролога, офтальмолога и педиатра, визуализацию в динамике выполняли нерегулярно.
В 13 лет 4 месяца появилась отрицательная динамика в виде дальнейшего снижения зрения, прибавки массы тела, появления слабости и головной боли. После референса гистологического исследования и проведения молекулярно-генетического исследования ткани опухоли в НМИЦ детской гематологии, онкологии и иммунологии верифицирован диагноз «пилоидная астроцитома, WHO grade 1, BRAF V600E — позитивная». По данным МРТ определялось опухолевое образование в хиазмально-селлярной области и переднебазальных отделах лобных долей, больше слева, объемом 24 см3 , нарастали симптомы гидроцефалии.
По экстренным показаниям в связи с отрицательной динамикой в неврологическом статусе была выполнена вентрикулоперитонестомия (ВПС) слева. Через 3 недели после ВПС инициирована специфическая терапия МЕК-ингибитором (траметиниб) и BRAF-ингибитором (дабрафениб). Через 3 недели таргетной терапии температура тела стала подниматься до фебрильных значений, сопровождаясь ознобом, но без гемодинамических нарушений, с нарастанием С-реактивного белка (СРБ) максимально до 192 мг/л (норма: 0–5).
Проводилась комбинированная противомикробная терапия: цефепим с последующей заменой на меронем, ванкомицин, флуконазол. Проведено дообследование (мультиспиральная компьютерная томография придаточных пазух носа и органов грудной клетки, Эхо-КГ, посев ликвора, микробиологическое исследование мазков со слизистых, анализ кала на условно-патогенную флору и возбудителей острых кишечных инфекций), инфекционных очагов не обнаружено. Лихорадку с повышением СРБ расценили как НЯ на фоне молекулярно-направленной терапии, в связи с чем она была прервана на 5 дней, после чего прием дабрафениба возобновили в монорежиме, а еще через 5 дней пациентке снова подключили траметиниб.
После возобновления терапии НЯ не отмечалось. Таргетное лечение продолжается уже 12 недель, и на его фоне (по данным МРТ) заболевание стабилизировалось. Из НЯ в последующем отмечалась кожная токсичность I степени (сыпь), не требующая модификации доз препаратов. Случай 3. У 11-летней девочки появились жалобы на головокружение, рвоту, шаткость походки. По результатам МРТ обнаружена опухоль продолговатого мозга с четкими контурами, распространяющаяся на левую среднюю и нижнюю ножки мозжечка. Гистологическое исследование биоптата опухоли выявило пилоидную астроцитому, WHO grade 1, а молекулярногенетическое — мутацию BRAF V600E. Начата специфическая терапия по протоколу SIOP LGG 2004—комбинация «карбоплатин + винкристин».
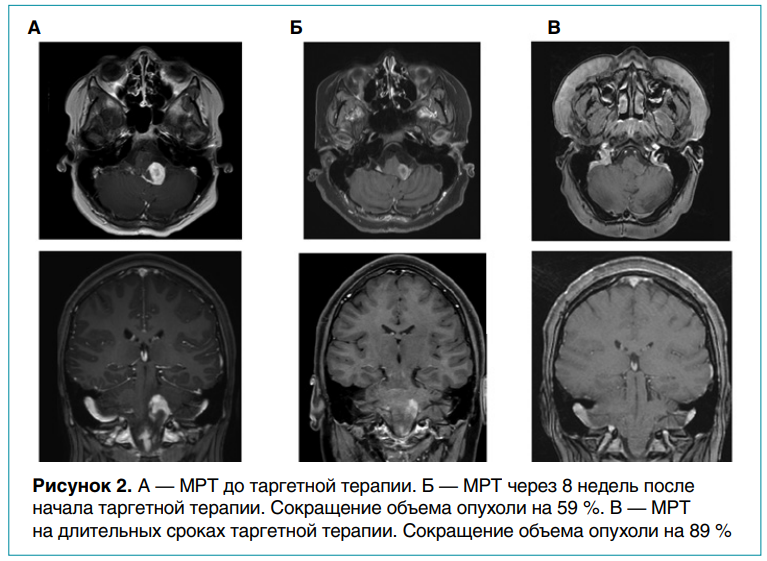
Контрольная МРТ через 8 недель терапии подтвердила стабилизацию заболевания, но у пациентки отмечалась отрицательная динамика в неврологическом статусе — появление бульбарной симптоматики (поперхивание жидкой пищей, стойкая навязчивая икота). Учитывая клиническую прогрессию заболевания, наличие в ткани опухоли мутации BRAF V600E, была назначена комбинированная таргетная терапия (дабрафениб + траметиниб). Контрольная МРТ через 8 недель терапии выявила сокращение размеров опухоли на 59 % (частичный ответ), а через 16 недель—на 89 % по сравнению с инициальным исследованием. Произошло также купирование бульбарной симптоматики и атаксического синдрома. Из НЯ отмечались выраженная прибавка веса и нарушение толерантности к глюкозе. В связи с развитием НЯ таргетную терапию отменили, назначили строгую диету и повысили уровень физической нагрузки с положительным эффектом. Через 21 день лечение возобновили в полном объеме. Сейчас его длительность составляет 35 месяцев, данных за прогрессию заболевания нет. По данным МРТ сохраняется большой частичный ответ (рис. 2).
ОТВЕТ НА ЛЕЧЕНИЕ
Назначение таргетной терапии BRAF-ингибиторами возможно только при наличии в ткани опухоли выявленной мутации BRAF V600E вне зависимости от локализации ЗНО, возраста пациентов и предшествующего лечения. Накопленный в НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева опыт позволяет рассматривать назначение ингибиторов в качестве первой линии терапии ГНСЗ. Данный метод лечения обладает приемлемым профилем токсичности по сравнению со стандартной химиотерапией, но риск возникновения серьезных НЯ требует от врача настороженности и знания молекулярных механизмов развития токсичности, отличающихся от таковых у классических химиопрепаратов. Мониторинг НЯ и адекватное сопроводительное лечение позволяют проводить таргетную терапию без длительных перерывов, что важно для сохранения достигнутого ответа на лечение.

















