Статьи
Информационные навигаторы в мире дженериков
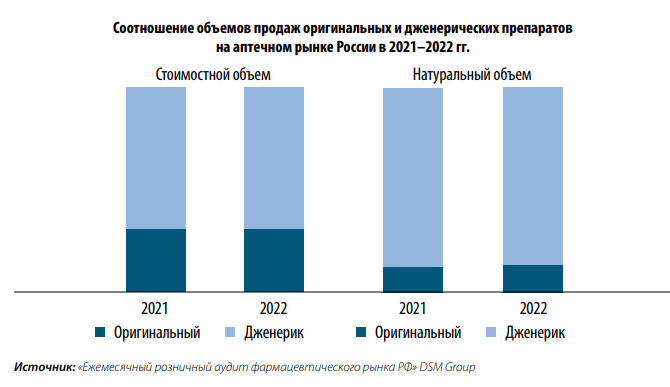
В 2022 г. в общей емкости российского фармрынка дженерики составили 69 % в стоимостном выражении и 86 % в упаковках. По прогнозам, к 2027 г. глобальный рынок дженериков в денежном выражении вырастет в 1,5 раза. Вместе с ролью дженерических препаратов возрастает необходимость ориентироваться в информации, связанной с ними. Рассмотрим информационные источники, которые могут помочь сделать аргументированные выводы о том или ином дженерическом лекарственном препарате (ЛП).
Государственный реестр лекарственных средств
С 2020 г. узнать, какой препарат оригинальный, а какой — воспроизведенный, можно из перечня взаимозаменяемых ЛП, размещаемого Минздравом РФ на сайте Государственного реестра лекарственных средств. Взаимозаменяемость и невзаимозаменяемость лекарственных средств определяются законодательно на основании выводов специальной комиссии. В список входит определенное количество международных непатентованных наименований (МНН). Для каждого МНН приведены референтный и взаимозаменяемый препараты. Так, данный перечень в группе «Взаимозаменяемые референтные лекарственные препараты» состоит из таких элементов, как торговое название оригинального или (при его отсутствии на территории РФ) референтного препарата; МНН; торговое название воспроизведенного ЛП; особые указания по замене, т. е. каким пациентам не стоит заменять референтный препарат на приведенный в списке дженерик.
Информация о взаимозаменяемости должна использоваться врачами при назначении препарата, входящего в отдельную группу в рамках одного МНН (химического или группировочного наименования). Взаимозаменяемость может быть ограничена в случаях индивидуальной непереносимости, по жизненным показаниям и (если в перечне имеются указания на исключение) для отдельных групп пациентов.
Сведения о взаимозаменяемости ЛП в рамках госзакупок представлены в Едином структурированном справочникекаталоге лекарственных препаратов. Это официальный онлайн-каталог, в котором содержится информация обо всех зарегистрированных в РФ лекарственных средствах. Платформа собирает данные о сертифицированных ЛП в автоматическом режиме и интегрирована с системой маркировки лекарств.
Белая и Оранжевая книги
«Белая книга» — реестр эквивалентности воспроизведенных ЛП, созданный по инициативе компании Morgan Frank. Это база данных, в которую компании-производители оригинального продукта представили данные по фармакокинетике препаратов, а производители дженерических средств — по фармацевтической и фармакокинетической эквивалентности препарата-дженерика оригинальному препарату и указали важные количественные отклонения от основных параметров. Эти данные позволяют проанализировать и сравнить лекарственные средства по таким критериям, как биоэквивалентность, биодоступность, страна производства, стандарт качества производственного процесса. Подтверждение биоэквивалентности, которое требуется нормативными документами, не является гарантией того, что дженерик будет давать тот же терапевтический эффект, что и оригинальный препарат. Важны исследования клинической эффективности, безопасности, фармакоэкономической приемлемости. В «Белой книге» дженерикам проставляется рейтинг RWB. Для оригинального препарата он равен 100, у качественного дженерика — превышает 75.
«Оранжевая книга» — более распространенное наименование «Списка утвержденных лекарственных препаратов с оценкой терапевтической эквивалентности» (Approved Drug Products with Therapeutic Equivalence Evaluations), разработанного американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA). В списке представлены в том числе и средства, доступные в России. Узнать, существует ли дженерик, эквивалентный фирменному препарату, можно, выполнив поиск по активным действующим веществам.
Пользователям доступны даты истечения срока действия патентов на оригинальные ЛП. Поиск лекарств наиболее удобен в мобильном приложении Orange Book Express. В публикуемых перечнях сравнения препаратов «Оранжевой книги» указывается двузначный TE code (Therapeutic Equivalence Evaluations Code) — код терапевтической эквивалентности. Он позволяет определить, одобрило ли FDA использование этого ЛП. Первая буква кода указывает на наличие или отсутствие у дженерика терапевтической эквивалентности оригинальному препарату: А — препарат эквивалентен, эффект от приема совпадает с эффектом оригинала, FDA одобряет; В — препарат неэквивалентен, FDA не рекомендует его назначать.
Вторая буква кода обозначает либо форму препарата, в которой доказана терапевтическая эквивалентность, либо проблему, по которой предположительно отсутствует эквивалентность.
Всемирная организация здравоохранения (ВОЗ) рекомендует подразделять дженерические ЛП на две категории. Категория А присваивается дженерикам, прошедшим клинические исследования на терапевтическую эквивалентность и имеющим отличия биоэквивалентности от оригинала не более 3–4 %. Категория В присваивается средствам, которые не прошли указанные клинические испытания.
Информационно-аналитическая система «Индекс Вышковского»
Индекс Вышковского — маркетинговый показатель, разработанный специалистами Регистра лекарственных средств России во главе с профессором Г.Л.Вышковским. Идея заключается в том, что, прежде чем приобрести или назначить лекарство, о нем собирается информация. Индекс отражает информационный спрос на лекарственные средства и определяется как отношение количества запросов на описание определенного бренда к общему числу запросов ко всем брендам в системе RLSNET® за определенный срок. Этот показатель может быть косвенно использован практикующими врачами при анализе дженерических ЛП. Чаще всего хорошо зарекомендовавшие себя на практике дженерики — обладатели высокого индекса Вышковского.
Сертификат GMP
Одним из важных маркеров качества дженерика является международный сертификат GMP (Good Manufacturing Practice — надлежащая производственная практика). В России его аналог выдает Министерство промышленности и торговли России. Данный сертификат есть у всех европейских крупных фармкомпаний. Ему соответствуют и многие российские производители ЛП, список которых доступен на официальном сайте Министерства промышленности и торговли России. Без этого сертификата нельзя выйти на фармрынок стран Евразийского экономического союза. Приведенный перечень информационных источников при рассмотрении вопроса о взаимозаменяемости оригинальных и дженерических препаратов помогает сделать выбор взвешенно, обдуманно и осторожно.
Елена Герман
Список литературы находится в редакции

















