Статьи
Продолжение эры детской онкоиммунологии. «Рогатая» мишень или обманка?
ЧТО ТЫ ТАКОЕ?
Ганглиозиды (углеводосодержащие сфинголипиды) относятся к группе сложных гликолипидов (от греч. γλυκός [glyko s] — сладкий и λίπος [lipos] — жир), образующихся в результате соединения липидов с углеводами. Локализуясь в плазматической мембране нервных и других клеток организма, ганглиозиды входят в структуру мембранных микродоменов, что делает большинство их подтипов непригодными в качестве мишени для противоопухолевого лечения. Исключение составляет дисиалоганглиозид GD2, который имеет ограниченную экспрессию на нормальных тканях организма человека, но при этом высоко экспрессирован в большом количестве солидных опухолей. Ассоциированные с опухолью ганглиозиды гиперэкспрессированы в клетках меланомы, нейробластомы (GD3, GD2 и GM2), карциномы (GD1a, GM1, GM2), саркомы мягких тканей (СМТ), остеогенной саркомы (ОС) и мелкоклеточного рака легких (GD2). В 2009 году Национальный институт рака США присвоил дисиалоганглиозиду GD2 12-е место среди 75 потенциальных мишеней для противоопухолевой терапии, создаваемой на основе потенциального терапевтического эффекта, степени экспрессии, иммуногенности и процента антигенспецифичных клеток.
В основе классификации ганглиозидов, предложенной шведским ученым Л.Свеннерхольмом (L.Svennerholm), лежат длина и строение углеводной (олигосахаридной) цепи. Ганглиозиды обозначают буквой G, подстрочные буквы М, D, Т, Q и Р говорят о числе молекул N-ацетилнейраминовой кислоты (М — одна, D — две, Т — три, Q — четыре и Р — пять), которая входит в состав олигосахаридных цепей. Цифры у подстрочной буквы обозначают специфическую последовательность углеводов в ганглиозиде, а литеры а, b и с — число молекул N-ацетилнейраминовой кислоты (а —одна, b—две и c—три), связанных с остатками центральной галактозы. Для обозначения остатков галактозы, глюкозы, N-ацетил-галактозамина, N-ацетилнейраминовой кислоты и церамидной части ганглиозидов используются латинские буквосочетания GaL, GLc, GaLNAc, NeuAc (NANA) и Cer соответственно.
Подтип GD2 ганглиозида содержит два остатка сиаловой кислоты, то есть является дисиалоганглиозидом, и связан с тремя моносахаридными единицами (рис. 1).
ПАТОЛОГИЧЕСКАЯ МОДУЛЯЦИЯ
Внутриклеточный синтез ганглиозидов начинается с образования церамидного ядра с последующим добавлением моносахаридного блока и транслокацией на плазматическую мембрану. Прикрепляясь к наружной плазматической мембране своей церамидной частью для регулирования чувствительности сигнальных молекул и функционирования в качестве медиаторов и модуляторов передачи сигналов, ганглиозиды взаимодействуют с мембранными белками и другими оболочечными липидами. Их моносахаридные единицы распространяются во внеклеточное пространство, где взаимодействуют с комплементарными гликан-связывающими белками для участия в распознавании клеток.
Ганглиозиды, сверхэкспрессируемые и активно высвобождаемые опухолевыми клетками, могут регулировать функцию нормальных клеток, присутствующих в микроокружении опухоли. Несколько исследований продемонстрировали модуляцию сигнальных путей фактора роста (ФР) через следующие его факторы:
-
эпидермальный ФР (epidermal growth factor, EGF);
-
ФР фибробластов (fibroblast growth factor, FGF);
-
тромбоцитарный ФР (platelet derived growth factor, PDGF);
-
семейство киназ рецептора тропомиозина (tropomyosin receptor kinase, Trk); * рецепторы инсулина.
Было обнаружено, что усиление мембран эндотелиальных клеток пупочной вены человека ганглиозидом GD1a приводит к индуцированию ФР эндотелия (vascular endothelial growth factor, VEGF), сигнализации и связанных с ней клеточных реакций пролиферации и миграции, важных для ангиогенеза. Ганглиозиды опухоли могут способствовать ее развитию, подавляя функцию иммунных клеток и способствуя механизмам иммунного уклонения и иммуносупрессии. Механизмы, с помощью которых ганглиозиды подавляют иммунную систему, до конца не поняты. Ганглиозиды могут ингибировать специфичную клеточную цитотоксичность, подавляя цитолитическую активность CD8+ Т-клеток, а также цитотоксичность, опосредованную NK-клетками. Развитие и функционирование дендритных клеток (ДК) имеет решающее значение на этапе инициации любого специфичного к антигенам иммунного ответа против опухолей. Есть много указаний на то, что опухольспецифические ганглиозиды регулируют развитие иммунитета опухоли посредством ингибирования функции ДК. Ганглиозиды способствуют формированию популяции ДК, характеризующейся снижением экспрессии CD86 (костимулирующий сигнал), а также продукции интерлейкинов 12 и 6.
ТАМ, ГДЕ ОПУХОЛЬ
Дисиалоганглиозид GD2 — основной ганглиозид, присутствующий в клеточных линиях нейробластомы человека,— синтезируется в большом количестве первичных опухолей и обнаруживается в плазме крови и самой нейробластоме независимо от стадии заболевания. Быстрое прогрессирование опухолевого процесса и низкие цифры выживаемости пациентов, как правило, связаны с более высокими уровнями циркулирующего GD2, полученного из опухоли, которые снижаются в ответ на терапию и снова повышаются при возникновении рецидива. Экспрессию GD2 на клетках нейробластомы можно обнаружить с использованием различных технологий, включая иммуноферментный анализ, окрашивание замороженных тканей иммунопероксидазой и жидкостную хроматографию высокого давления/тандемную масс-спектрометрию.
Саркома Юинга (СЮ) также изучалась на предмет экспрессии GD2. Результаты варьировали от отсутствия обнаруживаемой поверхностной экспрессии до диффузного и (или) интенсивного окрашивания в некоторых опухолях. Количественно экспрессия ранжировалась от 40 до 90 %. В исследованиях S. Kailayangiri и соавт. (2016) GD2 обнаружен в 100 % клеточных линий СЮ, что дало авторам публикации основание характеризовать GD2 как антиген СЮ, таргетный для терапевтических опций.
Остеогенная саркома (ОС) — наиболее распространенное первичное злокачественное новообразование (ЗНО) кости у детей и подростков. Основными методами лечения здесь служат нео- и адъювантная химиотерапия в сочетании с хирургической резекцией. Попытки международных кооперативных групп интенсифицировать режимы консервативного лечения у пациентов с диссеминированной формой заболевания, проводимые с 1970-х, не имели успеха. Добавление биологического агента — липосомального мурамилтрипептида фосфатидилэтаноламина (L‐MTP‐ PE) — привело к увеличению показателя выживаемости у пациентов с локализованным либо регионарным заболеванием, но абсолютно не изменило этот показатель у больных с метастатическим процессом. Вследствие чего необходимо развивать новое таргетное направление, нацеленное на терапию микрометастатического и субклинического заболевания. Иммуногистохимические (ИГХ) исследования обнаружили аберрантную экспрессию GD2 на опухолевых образцах, взятых у больных ОС, при этом экспрессия антигена сохранялась и в образце рецидива опухоли. К сожалению, в отличие от нейробластомы, GD2-экспрессия в саркомах гетерогенна как среди пациентов, так и внутри отдельных опухолей. Чтобы избежать антиген-негативного уклонения, GD2-специфическая иммунотерапия при этих видах ЗНО должна сочетаться со стратегиями, которые повышают экспрессию мишени до однородных уровней.
 М.Roth и соавт. (2014) использовали ИГХанализ для изучения экспрессии GD2 в клеточных линиях ОС 44 пациентов. Авторы наблюдали более высокую интенсивность окрашивания в образцах, полученных из рецидивной опухоли, по сравнению с образцами из первичного новообразования. Было высказано предположение о роли GD2 в приобретении опухолью химиорезистентности.
М.Roth и соавт. (2014) использовали ИГХанализ для изучения экспрессии GD2 в клеточных линиях ОС 44 пациентов. Авторы наблюдали более высокую интенсивность окрашивания в образцах, полученных из рецидивной опухоли, по сравнению с образцами из первичного новообразования. Было высказано предположение о роли GD2 в приобретении опухолью химиорезистентности.
W. Zhu и соавт. (2018) выявили синергический эффект анти-GD2 моноклональных антител (МА) и цисплатина по сравнению с их моновоздействием на клетки ОС. Результаты показали, что цисплатин в сочетании с анти-GD2 МА может быть эффективной терапевтической стратегией для ОС. J.P. Heiner и соавт. (1987) протестировали образцы ОС 17 пациентов на наличие в них GD2 после воздействия анти-GD2 МА и обнаружили, что в 15 из 17 (88,2 %) опухолей более чем 95 % клеток имели высокую интенсивность окрашивания (3+ или 4+). Две опухоли со слабой интенсивностью окрашивания оказались вариантами злокачественной фиброзной гистиоцитомы.
E.R. Butch и соавт. (2019) использовали позитронно-эмиссионную томографию (ПЭТ) для оценки способности нового радиомаркированного гуманизированного анти-GD2 МА ([64Cu]Cu-Bn-NOTAhu14.18K322A) к определению экспрессии GD2 в мышиной модели ОС in vivo. Поглощение опухолью меченого радиоактивным веществом МА было в 7 раз выше при умеренно GD2-экспрессирующих ОС, чем при GD2-отрицательной опухоли. ПЭТ-сканирование позволило идентифицировать поражения размером до 29 мм3 в 34 % GD2-положительных моделей метастатической ОС (pulm+). Эти результаты подтверждают ценность экспрессии GD2, возможность ее качественного и количественного определения на клетках ОС с помощью визуализирующих методик.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
 В публикации R.H. Chang и соавт. (1992) при исследовании тканей 56 свежезамороженных образцов СМТ человека методом ИГХ-окрашивания обнаружена экспрессия GD2 в 52 (93 %) образцах. В противоположность нейробластоме наиболее слабая экспрессия была выявлена в более агрессивных опухолях (эмбриональная рабдомиосаркома и синовиальная саркома). В 2019 году A.J. Saraf и соавт. среди 16 образцов рабдомиосаркомы диагностировали лишь 25 % GD2-позитивных опухолей. Возможно, что небольшой процент экспрессии был связан с малой выборкой пациентов (всего 16) и использованием архивных замороженных тканей, что не исключает увеличения числа ложноотрицательных результатов.В двух федеральных центрах (НМИЦ онкологии имени Н.Н. Петрова и НМИЦ онкологии имени Н.Н. Блохина) для количественного определения GD2-антигена был создан протокол исследования GD2 в солидных опухолях с помощью проточной цитометрии, который включил два этапа — пробоподготовку (выделение клеточной суспензии из опухолевого фрагмента, криоконсервация опухолевых клеток) и определение GD2 на поверхности опухолевых клеток с помощью проточного цитофлуориметра BD FACSCanto™ II. Анализу подверглись 35 образцов опухолевой ткани ОС (n = 10), СЮ (n = 11) и СМТ (n = 13). Процент GD2-положительных опухолевых клеток оценивался как непрерывный параметр (от 0 до 100 %).
В публикации R.H. Chang и соавт. (1992) при исследовании тканей 56 свежезамороженных образцов СМТ человека методом ИГХ-окрашивания обнаружена экспрессия GD2 в 52 (93 %) образцах. В противоположность нейробластоме наиболее слабая экспрессия была выявлена в более агрессивных опухолях (эмбриональная рабдомиосаркома и синовиальная саркома). В 2019 году A.J. Saraf и соавт. среди 16 образцов рабдомиосаркомы диагностировали лишь 25 % GD2-позитивных опухолей. Возможно, что небольшой процент экспрессии был связан с малой выборкой пациентов (всего 16) и использованием архивных замороженных тканей, что не исключает увеличения числа ложноотрицательных результатов.В двух федеральных центрах (НМИЦ онкологии имени Н.Н. Петрова и НМИЦ онкологии имени Н.Н. Блохина) для количественного определения GD2-антигена был создан протокол исследования GD2 в солидных опухолях с помощью проточной цитометрии, который включил два этапа — пробоподготовку (выделение клеточной суспензии из опухолевого фрагмента, криоконсервация опухолевых клеток) и определение GD2 на поверхности опухолевых клеток с помощью проточного цитофлуориметра BD FACSCanto™ II. Анализу подверглись 35 образцов опухолевой ткани ОС (n = 10), СЮ (n = 11) и СМТ (n = 13). Процент GD2-положительных опухолевых клеток оценивался как непрерывный параметр (от 0 до 100 %).
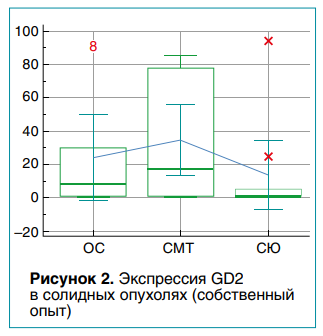
Положительная экспрессия GD2 была найдена в 32 (94,1 %) из 34 опухолевых образцов. Результаты экспрессии GD2 в клеточных линиях ОС, СМТ и СЮ варьировали от отсутствия до интенсивного окрашивания в некоторых образцах. Клеточные культуры ОС и СМТ имели количественную экспрессию GD2 от 0,0 до 91,6 % (среднее значение — 23,8 ± 11,4 %) и от 0,1 до 84,9 % (среднее значение — 34,5 ± 9,8 %) соответственно. Результаты экспрессии GD2 в клеточной линии СЮ несколько уступали вышеназванным типам неоплазий — от 0,2 до 94,0 %; среднее значение составило 13,2 ± 9,3 % (рис. 2).
Учитывая успехи анти-GD2-направленной терапии, использующейся во время постконсолидации при нейробластоме, на наш взгляд, необходимо рассматривать возможность включения данной опции при лечении других GD2-позитивных опухолей, например ОС, СЮ и СМТ. В последние несколько лет в детской клинической практике актуализировался вопрос применения иммунотерапии. Но для действительного ускорения процесса развития в данной области нужно осознать важность не только самой модуляции иммунной системы, но и противодействия иммуносупрессивной микросреде. Чтобы реализовать весь потенциал иммунотерапии, вероятно, потребуется разработать стратегии или методы лечения, нацеленные на использование синергизма активации иммунной системы и торможения микроокружения опухоли.
Читайте также
- Возможности радиационной иммуномодуляции в лечении онкологических заболеваний
- Мультидисциплинарный подход к лечению сепсиса у детей с онкогематологическими заболеваниями
- Рак щитовидной железы у детей: ключевые рекомендации
- Аллогенная трансплантация костного мозга: не только при лейкозах
- Иммуноглобулины для подкожного введения — новая эра иммуномодулирующей терапии
- Междисциплинарное взаимодействие в детской онкохирургии

















