Статьи
Что с тобой, бета-клетка?
«Современные аспекты патогенеза сахарного диабета (СД) 2‑го типа: β-клетка, что с тобой?» — пленарную лекцию под таким названием на XXI московском городском съезде «Эндокринология столицы — 2025» представил профессор А.С. Аметов.
Рост распространенности СД носит эпидемический характер. Даже самые смелые прогнозы ежегодно оказываются ниже фактических. Так, например, прогноз, сделанный в 2011 году на 2030‑й, реализовался на 10 лет раньше. С поправкой на все факторы, включая коронавирусную инфекцию, СД является основным драйвером роста мировой смертности. В 2021 г., когда диабетом страдали 537 млн человек, с ним оказались связаны 6,7 млн смертей (12 % от общемировой летальности), причем треть из них пришлась на людей младше 60 лет. Даже научившись успешно снижать гликированный гемоглобин, мы глобально проигрываем войну против СД, поскольку все еще не имеем точных ответов на четыре вопроса:
• Каковы патофизиологические причины, вызывающие развитие СД?
• Какие первичные генетические дефекты приводят к метаболическим нарушениям?
• Почему у разных пациентов наблюдается различное клиническое течение заболевания?
• Почему на одну и ту же терапию больные отвечают по-разному?
Чтобы ответить на эти вопросы, нужно хорошо представлять себе все звенья патогенеза СД, ключевыми среди которых являются нарушения работы β-клеток.
ОСТРОВКОВЫЕ КЛЕТКИ
Профессор А.С. Аметов продемонстрировал снятую под электронным микроскопом фотографию здоровых островковых клеток человека (рис. 1), предназначенных для введения больному СД 1‑го типа в соответствии с Эдмонтским протоколом (методом трансплантации островковых клеток поджелудочной железы, разработанным 25 лет назад). После этого в течение как минимум года пациент не будет нуждаться в инъекциях инсулина.

Протокол предполагает выделение большого количества островков из поджелудочных желез двух-трех доноров с использованием ферментов. Островки вводятся в портальную вену печени реципиента. Во время и после трансплантации пациент получает иммуносупрессивную терапию. Пятилетнее наблюдение за реципиентами показало, что большинству из них потребовалось возобновление инсулинотерапии лишь через 3–5 лет, а около 10 % остались полностью инсулинонезависимыми к пятому году.
Друг и ученик великого Вирхова, немецкий анатом и гистолог Пауль Лангерганс (рис. 2), проживший всего 41 год, еще будучи студентом третьего курса университета Фридриха Вильгельма в Берлине, то есть более 150 лет назад, сообщил о том, что обнаружил в поджелудочной железе кролика бледные (палевые) пятна, ставшие предметом повышенного интереса со стороны исследователей.
 Чего только с β-клетками потом не делали! Их окрашивали и делили, вводили пациентам и давали вместе с пищей, их маркировали, пытались сосчитать, извлекали и выделяли, пробовали истощать и, наоборот, стимулировать — и все-таки до сих пор неясно, почему они должны существовать в таком виде. Непризнанный гений с трагической судьбой — наш великий ученый Леонид Васильевич Cоболев (рис. 3) — в своей монографии одним из первых описал эндокринный аппарат поджелудочной железы, 98 % всей ткани которой составляет экзокринная часть, а островки Лангерганса занимают всего 1–2 %.
Чего только с β-клетками потом не делали! Их окрашивали и делили, вводили пациентам и давали вместе с пищей, их маркировали, пытались сосчитать, извлекали и выделяли, пробовали истощать и, наоборот, стимулировать — и все-таки до сих пор неясно, почему они должны существовать в таком виде. Непризнанный гений с трагической судьбой — наш великий ученый Леонид Васильевич Cоболев (рис. 3) — в своей монографии одним из первых описал эндокринный аппарат поджелудочной железы, 98 % всей ткани которой составляет экзокринная часть, а островки Лангерганса занимают всего 1–2 %.
Островок — это самостоятельный мини-орган, предназначенный для производства и секреции в необходимых количествах ряда гормонов, в нужное время участвующих в регуляции собственных процессов гомеостаза глюкозы (и не только). В поджелудочной железе длиной примерно 20 см насчитывается 1 млн островков, каждый приблизтельно 200 мкм в диаметре, причем β-клетки диаметром 15 мкм составляют 75 % эндокринных клеток островка, а всего их там насчитывается около 3 тыс.
В организме взрослого ежедневно вырабатывается около 10 пкг инсулина на одну клетку (пикограмм — одна триллионная грамма). Масса же β-клетки составляет от 0,6 до 2,1 пкг. Весь пул β-клеток выделяет приблизительно 30–70 ЕД инсулина в сутки. Всего же в островках Лангерганса насчитывается 5 типов клеток:
• α-клетки составляют 15–20 % пула островковых клеток, секретируют глюкагон;
• β-клетки (75–80 %) секретируют инсулин и многофункциональный пептидный гормон амилин;
• δ-клетки (3–10 %) секретируют соматостатин;
• ПП-клетки (3–5 %) секретируют панкреатический полипептид (ПП);
• ε-клетки продуцируют грелин. Их число прогрессивно снижается в течение жизни.
В островках взрослого человека обнаруживается лишь немного грелин-позитивных клеток. Соматостатин и грелин являются локальными регуляторами секреции инсулина. При диаметре 10 мкм здоровая β-клетка содержит 10 тысяч секреторных гранул. Образуется она при помощи неогенеза и репликации, а период ее полужизни составляет 5 лет. На первый взгляд все β-клетки выглядят одинаково. Но 10 % общего пула составляют клетки с командной функцией. Это β-клетки-хабы — водители и синхронизаторы ритма. Хабы вырабатывают меньше инсулина, зато способны к быстрому анализу концентрации глюкозы в микрососудистом русле. А главное — каждая клетка-хаб регулирует синхронную секрецию инсулина шестью-семью соседними β-клетками. Возможно, именно хабы являются ахиллесовой пятой в плане различных поломок, связанных с нарушением секреции инсулина и развитием диабета. Сейчас активно разрабатывается теория о роли клеток-водителей ритма в патогенезе СД 2‑го типа.
ВЫХОД В КОСМОС
Биосинтез инсулина — полностью параллельная, независимая от процесса его секреции функция пополнения запасов данного гормона во внутриостровковых инсулиновых пулах. Клетка диаметром 10 мкм имеет на своей поверхности целую сеть глюкорецепторов, определяющих, что это именно глюкоза, а также какова ее концентрация. Ориентируясь на эти данные, β-клетка дает разрешение глюкозе проникать внутрь нее, как и в любую другую клетку. Попав внутрь β-клетки, глюкоза стимулирует множество биологических субстратов, которые участвуют в прохождении сигнала.
В результате изменения соотношения АТФ/ АДФ закрываются калиевые каналы с последующей деполяризацией клеточной мембраны и открываются каналы Ca2+. И уже через минуту после опознания β-клеткой молекулы глюкозы происходит вертикальный взлет секреции инсулина, столь же мощный и стремительный, как взлет космического корабля. Попытки ученых создать прандиальный инсулин направлены на приближение к данному физиологическому процессу. Но уже к 30‑й минуте после начала этого взлета уровень инсулина возвращается на исходные позиции.
Помимо прандиальной существует и базальная секреция инсулина. Она состоит из 11–15 медленных волн в течение суток. Соответственно, у пациента с СД 2‑го типа отмечены достоверные суточные ритмы концентрации глюкозы в крови с максимальным содержанием утром, постепенным снижением в течение дня и повторным повышением вечером. В этих ритмах участвуют не только β-клетки, секретирующие инсулин, но и α-клетки, вырабатывающие глюкагон. Современная инсулинотерапия направлена на имитацию физиологических параметров секреции инсулина. Но в организме есть ряд других механизмов запуска секреции инсулина: не сработал один — обязательно включится другой.
Вместе с инсулином островковые клетки синтезируют и секретируют в ответ на поступление пищи островковый амилоидный полипептид (IAPP) — амилин, играющий важную роль в регуляции метаболизма глюкозы. Еще в 1996 г. был синтезирован генно-инженерный амилин, чтобы использовать такие его уникальные эффекты, как усиление чувства насыщения, замедление эвакуации пищи из желудка и подавление печеночной продукции глюкозы.
НЕБРОУНОВСКОЕ ДВИЖЕНИЕ
На поверхности β-клетки находится так называемый поверхностный протеом — около тысячи различных белков, выполняющих функцию обмена информацией с разными органами и тканями. Эта сеть из белков разнообразной структуры взаимодействует с молекулами окружающей среды: метаболитами, ионами, гормонами, различными пептидами — и связана по крайней мере с одним из четырех наиболее важных аспектов жизни здоровой β-клетки (дифференцировкой, выживанием, пролиферацией и секрецией инсулина). На экспериментальных моделях и в опытах с участием людей показано, что островки больного СД усеяны пустыми, то есть функционально неактивными, β-клетками, что объясняет концепция специфического истощения белков клеточной поверхности в связи не только с патогенезом диабета, но и с естественным старением. Очень важен с практической точки зрения феномен метаболической гибкости (или пластичности) эндокринной части поджелудочной железы, способной реагировать на различные потребности организма в инсулине.
Панкреатическую β-клетку часто сравнивают с топливным сенсором. Ведь она непрерывно отслеживает концентрацию циркулирующих нутриентов и при участии дополнительных нейрогормональных сигналов обеспечивает оптимальный инсулиновый ответ, покрывающий потребности организма в энергии. Трудно представить, насколько сложна эта система регулирования со стороны 1 млн островковых клеток, направленного на достижение гликемического контроля и на обеспечение тканей и органов (в первую очередь головного мозга — ГМ) важным энергетическим субстратом. Не менее сложен и механизм управления функционированием островков со стороны ЦНС. Двунаправленные регуляторные влияния в рамках оси «островковые клетки — мозг» в значительной степени обеспечивают гомеостаз глюкозы.
Глюкоза мчится в каждую клеточку, которая в данный момент нуждается в энергии. На первый взгляд ее движение подобно броуновскому, но на самом деле это управляемое скоординированное действие направлено на адресную доставку ее молекул в нуждающиеся ткани. Глюкоза поступает в кору ГМ в ответ на системный запрос энергии в строго определенных количествах и с определенной скоростью. Днем этот процесс обеспечивается приемами пищи, а ночью — печенью и почками. Глюкоза проникает через гематоэнцефалический барьер с помощью транспортного белка GLUT‑1. Важная роль в этих жестко контролируемых процессах жизнеобеспечения принадлежит и лептину. Вместе с инсулином он регулирует гомеостаз энергии, оповещая головной мозг о ее запасах на уровне жировой ткани. В метаболизме глюкозы участвуют также нейропептид γ, α-меланоцитстимулирующий гормон и глюкокортикоиды.
При изучении в течение длительного времени динамики концентрации глюкозы в ГМ были зарегистрированы ровные линии без каких-либо всплесков. Ведь если уровень глюкозы в ГМ повысится, то разовьется глюкозотоксичность. А если он будет ниже необходимых физиологических значений, то возникнет дефицит глюкозы, а значит, и нейрогликопения. И то и другое очень опасно. Поэтому контроль гомеостаза глюкозы помогает поддерживать физиологические параметры в рамках допустимых суточных колебаний.
УХОДЯЩИЙ ПОЕЗД
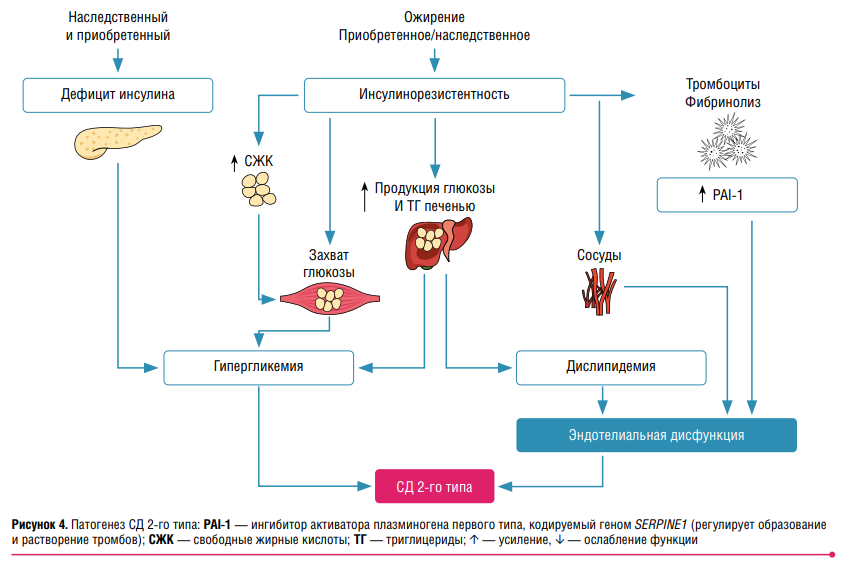
Весомый вклад в развитие СД 2‑го типа вносят ожирение и наследственно приобретенный дефицит секреции инсулина с развитием инсулинорезистентности (ИР) в сочетании с гиперпродукцией глюкозы печенью. Также повышается концентрация триглицеридов (ТГ) с последующей дислипидемией, ростом концентрации свободных жирных кислот (СЖК) и сниженным захватом глюкозы (рис. 4), что ведет к гипергликемии с развитием глюкозотоксичности. У больного еще нет диагноза «диабет», но уже есть глюкозо- и липотоксичность, дислипидемия, отложения амилоида и воспаление. А мы спокойно ждем… Дальше поражаются сосуды, возникают нарушения свертывающей системы крови, развивается эндотелиальная дисфункция с микро- и макрососудистыми осложнениями. Но у нас все еще нет диабетического диагноза! И когда мы его наконец-то устанавливаем, то говорим: «Давайте скорее снижать сахар и гликированный гемоглобин!» — игнорируя все вышеперечисленные фатальные события. Но делать это уже поздно. Усиливается апоптоз β-клеток, не компенсирующийся адекватной регенерацией, что приводит к снижению секреции инсулина.
А когда же стартуют все эти печальные события? Развитие диабета начинается еще в утробе матери на фоне генетической предрасположенности, эпигенетических модификаций, в первую очередь митохондриальной дисфункции и оксидативного стресса. Независимо от веса ребенка при рождении (менее 2,5 кг или более 4 кг — одинаково опасно) он уже появляется на свет с ИР. К 30 годам у него в 7–10 раз повышается риск развития не только СД, но и гипертензии, ИБС, НАЖБП и других составляющих метаболического синдрома.
По словам профессора Ральфа А. Де Фронзо, заместителя директора Техасского института диабета (США), СД 2‑го типа — это кульминация двух одномоментно развивающихся дефектов: ИР и дисфункции β-клеток с последующим возникновением глюкозо- и липотоксичности. Ряд патогенетических путей во время беременности влияет на развитие ожирения и СД 2‑го типа. Мы обязаны заниматься данной проблемой с внутриутробного периода, а не пытаться сесть в поезд, который давным-давно набрал скорость.
Уже на стадии предиабета нарушение секреции инсулина связано с ростом содержания панкреатического жира. β-клетки таких пациентов все сильнее пропитываются жировыми вакуолями. Речь идет не о резервном жире, использующемся для обеспечения энергетических потребностей клетки, а о чрезмерном. На фоне липотоксичности снижается секреция инсулина. Ослабление функции и уменьшение массы β-клеток прямо пропорциональны снижению инкретинового эффекта. Это приводит к сокращению неогенеза и пролиферации β-клеток, их апоптозу на фоне все нарастающего ухудшения функций оставшихся островковых клеток.
Кроме того, низкая секреция соматостатина приводит к усиленному синтезу глюкагона α-клетками. На этом фоне снижается постпрандиальный инсулиновый ответ, возрастает продукция глюкозы печенью и падает ее периферический захват. Все это приводит к развитию глюкозотоксичности и СД 2‑го типа, причем дефицит инкретинового эффекта у больных при СД 2‑го типа возникает еще на стадии нарушенной толерантности к глюкозе.
Сегодня активно изучается проблема дедифференциации β-клеток, в результате которой они начинают вырабатывать глюкагон вместо инсулина. Традиционно этот процесс рассматривался как однозначно вредный. Однако теперь складывается мнение, что дедифференцированные β-клетки при определенных условиях могут вернуться к производству инсулина, став вероятным источником пополнения пула нормальных β-клеток.
Объектом исследований все чаще становятся и белковые факторы транскрипции FoxO, влияющие на семейство соответствующих генов-мишеней, а значит, и на все значимые процессы в клетке. До недавних пор фокус интереса в изучении данных белков приходился на онкологию, но сегодня уже ясно, что они также участвуют в регуляции эффектов инсулина, лептина, продукции глюкозы печенью, синтезе триглицеридов и желчных кислот, функционировании β-клеток, дифференциации прогениторных энтероэндокринных клеток, атерогенезе, функции эндотелия. Этой теме посвящается все больше исследований, и, возможно, их результатом станет открытие новых молекулярно-генетических механизмов СД.
Александр Рылов, к.м.н.

















