Статьи
Новая эра скрининга новорожденных
Скрининг — одно из важнейших профилактических мероприятий в сфере здравоохранения. В последние годы, прежде всего благодаря технологии тандемной масс-спектрометрии (ТМС), возможности неонатального скрининга расширились на десятки заболеваний. В России вопрос о поэтапном расширении скрининга новорожденных вошел в перечень поручений председателя Правительства РФ М.В. Мишустина от 15 июля 2021 года.
Согласно одному из определений, «скрининг включает клинические и лабораторные обследования индивидуумов, у которых на момент обследования нет проблем со здоровьем, с целью выявления заболевания, предрасположенности к болезни или факторов риска, которые повышают риск развития заболевания». Очень важно иметь четкий перечень болезней, на которые проводится массовое обследование.
В 1968 году Уилсон и Джангнер опубликовали монографию «Принципы и практика скрининга на выявление заболеваний». Этот труд заложил организационно-методические основы для проведения скрининговых мероприятий. Критерии, предложенные Уилсоном и Джангнером, были впоследствии рассмотрены и дополнены многими экспертами и организациями, в том числе Советом Европы, и сегодня выглядят так:
- заболевание, на которое нацелена программа скрининга, должно быть важной медико-социальной проблемой вследствие высокого уровня смертности при данной болезни, тяжести ее течения, экономических или социальных издержек государства;
- патогенез болезни должен быть хорошо изучен, у заболевания должен быть начальный скрытый период, либо должны быть определены факторы риска, которые можно было бы выявить с использованием диагностических тестов. Тесты должны быть высокочувствительными и специфичными по отношению к данному заболеванию, а также приемлемыми для обследуемого индивидуума;
- обязательным условием скрининга является возможность адекватного лечения или иного вмешательства. Адекватность лечения определяется доказанной клинической эффективностью, этической и правовой приемлемостью;
- скрининг с последующим проведением медицинского вмешательства на ранней стадии болезни должен обеспечивать лучший прогноз для больного, чем его лечение при появлении симптомов болезни.
Экспертная группа Американской коллегии медицинской генетики (ACMG) описала процесс определения перечня заболеваний для универсальной и единой программы скрининга новорожденных (табл. 1). ACMG выделила 29 заболеваний — список, называемый основной панелью. В первую группу включены: три формы гемоглобинопатий; шесть — аминоацидурий; пять — нарушений окисления жирных кислот; девять — органических ацидурий; и еще шесть различных состояний — врожденный гипотиреоз, муковисцидоз, галактоземия, адреногенитальный синдром, дефицит биотинидазы и врожденная тугоухость. Двадцать из этих состояний выявляются МС/МС-анализом аминокислот и ацилкарнитинов. Кроме 29 обязательных заболеваний, ACMG сформировала дополнительную панель из 25 позиций, для которых клиническая целесообразность скрининга не столь очевидна. Тем не менее, особенно в тех случаях, когда заболевание выявляется в результате одного и того же исследования методом ТМС, включение дополнительных заболеваний в основную панель возможно. Появление новых препаратов патогенетического действия для лечения наследственных болезней обмена делает это вполне обоснованным.

Неонатальный скрининг методом ТМС, как и любой другой скрининг, состоит из трех этапов — преаналитического, аналитического и постаналитического. Крайне важно придерживаться сроков забора капиллярной крови: при методе ТМС он осуществляется через 48 часов после рождения ребенка, что, учитывая современную тенденцию к ранней выписке рожениц, выгодно выделяет эту технику на фоне других. Для забора используют специальные фильтровальные бумажные тест-бланки Whatman 903, которые можно получить в государственном или муниципальном учреждении здравоохранения. Тест-бланк высушивают в горизонтальном положении на чистой обезжиренной поверхности не менее 2 часов и отправляют в центр скрининга.
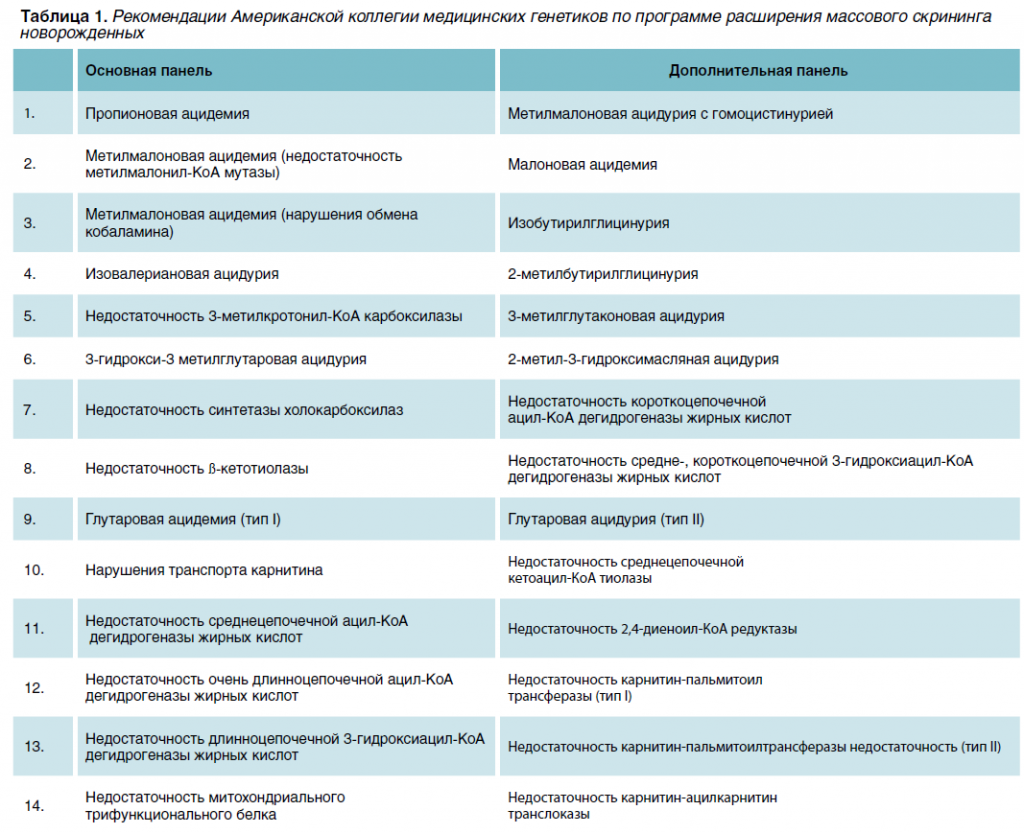
Доставка тест-бланка с высушенными пятнами крови не требует определенных условий хранения и, если исследование не требует срочности, бланк можно доставить почтой. Общий алгоритм аналитического этапа скрининга методом ТМС представлен на рисунке.
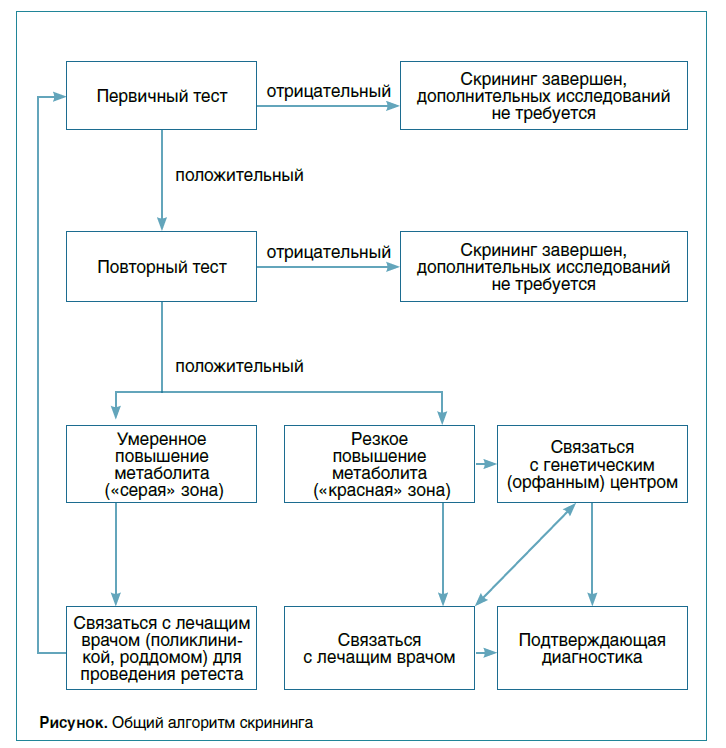
Постаналитический этап включает подтверждающую диагностику и медико-генетическое консультирование семей, в которых выявлен ребенок с наследственным заболеванием. Программы скрининга позволяют только предположительно выявить больных НБО, поэтому диагноз нужно обязательно подтвердить. Современные методы хроматографии и ферментной диагностики уже много лет применяются для верификации многих наследственных болезней обмена, включенных в программы неонатального скрининга. Но, пожалуй, наибольшее значение для подтверждения диагноза сейчас приобрели методы молекулярной генетики. На сегодняшний день картированы гены большинства НБО, и в ряде случае трудоемкие стики с успехом можно заменять более дешевыми молекулярно-генетическими методами. Кроме того, ДНК-диагностика незаменима для установления носительства в отягощенных семьях. Методы подтверждающей диагностики нарушений, выявляемых техникой МС/МС, представлены в таблице 2.
Массовый скрининг, проводимый во многих странах мира десятилетиями, показал высокую эффективность. Однако число скринируемых заболеваний среди новорожденных широко варьирует в различных странах — от 2 до 50 и более. В перечень редких болезней для расширенного неонатального скрининга в РФ в основном предлагают включить заболевания, которые главным образом лечатся применением специализированных продуктов лечебного питания. Важно отметить, что для большей части представленных нозо- логий используются одни и те же продукты лечебного питания, что позволяет сократить финансовые затраты государства на эффективную терапию пациентов. Мы считаем, что в рамках государственной программы импортозамещения полезно рассмотреть вопрос о расширении производства отечественных специализированных смесей и ЛС, включив туда продукты для лечения вновь выявленных скринингом болезней. Для некоторых нозологий есть аналоги продуктов лечебного питания российского производства. В РФ ряд специализированных продуктов лечебного питания и некоторых ЛС для лечения скринируемых заболеваний пока находятся в процессе регистрации. С учетом невысокой стоимости и небольшого перечня незарегистрированных препаратов, предлагается рассмотреть возможность их ввоза в Россию согласно принятому порядку.
Благодаря расширенному скринингу ежегодно можно выявить более 900 дополнительных курабельных пациентов, тогда каждый год получится обнаружить почти 2 тыс. детей с нарушениями обмена веществ, для которых существует патогенетическое лечение.
Это позволит снизить младенческую смертность и увеличить среднюю продолжительность жизни в РФ.
Расширенный неонатальный скрининг целесообразнее проводить в окружных межрегиональных медико-генетических центрах с необходимым медицинским оборудованием, учитывая численность населения и планируемое число новорожденных. Должно быть предусмотрено создание центра, который занимался бы: контролем качества неонатального скрининга методом ТМС и молекулярно-генетических исследований; проведением подтверждающей диагностики биохимическими и молекулярно-генетическими методами; обучением врачей-генетиков, врачей —лабораторных генетиков, лабораторных техников по проведению скрининга и подтверждающей диагностики, а также медикогенетического консультирования; разработкой стандартных операционных процедур по проведению скрининга и клинических рекомендаций и стандартов по диагностике и лечению скринируемых заболеваний. Также необходим методический центр организации лечения и реабилитации пациентов с наследственными заболеваниями, выявленных в результате скрининга. Там бы занимались: разработкой клинических рекомендаций по диагностике и лечению наследственных заболеваний, выявляемых в результате скрининга; разработкой стандартов оказания медицинской помощи выявленным пациентам; контролем качества оказания медицинской помощи пациентам, выявленным в результате скрининга; оказанием медицинской помощи в стационарных условиях; проведением телемедицинских консультаций по коррекции лечения выявленных пациентов.
Скрининг на наследственные болезни требует дополнительных затрат от государства, но при этом во многих случаях может быть эффективным, с точки зрения здравоохранения. Расчеты экономического эффекта от скрининга новорожденных включают денежный эквивалент предотвращенных случаев смерти и снижение затрат на лечение осложнений, связанных с поздней диагностикой, за вычетом дополнительных затрат на скрининг, диагностику и лечение. Также, чем ниже распространенность болезни, тем выше стоимость выявленного случая, что отражается на экономической эффективности скрининга. По этой причине мультиплексное тестирование, например ТМС, — оптимальная стратегия повышения рентабельности скрининга для заболеваний с низкой распространенностью.
Выводы, сделанные из исследований, проведенных в разных странах Европы и США, показывают, что скрининг, например, на дефицит среднецепочечной ацил-КоА-дегидрогеназы жирных кислот (MCAD) с использованием ТМС является экономически эффективным. В Великобритании экономическая выгода от проведения скрининга методом ТМС только на ФКУ и MCAD составляет 23 312 фунтов на 100 тыс. обследованных новорожденных.
В штате Вашингтон (США) анализ внедрения скрининга на MCAD прогнозировал соотношение «выгоды/затраты» 3,4 : 1 исходя из предположений о снижении младенческой смертности при этом заболевании на 20,0 % и снижении серьезной инвалидизации на 13,9 %.
При анализе соотношения «затраты/эффективность» были показаны затраты 48 тыс. долл. США на год сохраненной жизни.
Также были проведены исследования для глутаровой ацидурии типа 1 (GA-I). В течение 20‑летнего горизонта скрининг на GA-I снижает на 3,7 DALY (95 % ДИ: 2,9–4,5) и сохраняет приблизительно год жизни (95 % ДИ: 0,7–1,4) на 100 тыс. новорожденных, прошедших скрининг. Кроме того, программа скрининга экономит в общей сложности около 30 682 евро (95 % ДИ: 14 343–49 176 евро) на 100 тыс. обследованных новорожденных за 20‑летний период.
В некоторых странах была проведена оценка эффективности ТМС для множества болезней. Так, в Австралии общая стоимость тестирования (без учета затрат на лечение) оценивалась в 218 тыс. австралийских долл. на 100 тыс. новорожденных. Стоимость предотвращенного случая смерти составила 472 913 австралийских долл., а стоимость года сохраненной жизни — 10 779 австралийских долл.; эти данные сопоставимы с существующими стандартами экономической эффективности медицинских технологий.
Проведенное в Канаде исследование показало, что для большинства болезней при скринировании методом ТМС на одно заболевание вычисленный ICER (инкрементальный коэффициент «затраты/ эффективность») составил около 100 тыс. долл. на год сохраненной жизни (LYG). При скрининге на группу из 14 НБО, включая ФКУ, — менее 70 тыс. долл. на LYG. Учитывая, что в некоторых регионах РФ может также наблюдаться высокая частота отдельных заболеваний благодаря высокой инбредности популяций, провести до начала исследований фармакоэкономический анализ для всей РФ довольно затруднительно.
Расширение неонатального скрининга и добавление в его программу новых наследственных заболеваний, для которых существует современное патогенетическое лечение, очень важно: только так можно выявить болезнь на раннем этапе и своевременно начать терапию. Внедрение в практику метода ТМС и расширение программы скрининга до 39 заболеваний — в идеале первый очевидный этап расширения скрининга. В последующем необходимо обсуждать и продвигаться к внедрению скрининга на наследственные иммунодефициты, лизосомные болезни накопления, спинальную мышечную атрофию и другие заболевания.
Читайте также
- Приглашаю на шестнадцатилетие!
- Болезнь Виллебранда: верхушка айсберга
- Визуализация в педиатрии: современные подходы
- Абилитация и ведение недоношенных детей: поможет новая служба
- Заменяем грудное молоко с умом
- Пренатальная коррекция Spina bifida и ее исходы
- Обеспеченность витаминами – фактор здоровья
- Пренатальное тестирование: от материнского возраста к ДНК плода
- Первая декада отечественной паллиативной помощи детям

















